
【题目】下列说法不正确的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.单质分子中不一定有化学键
科目:高中化学 来源: 题型:
【题目】下列关于离子的叙述,正确的是( )
A.阴离子中不可能含金属元素
B.金属离子参与氧化还原反应时,既可能被氧化又可能被还原
C.Na2O2中阴阳离子个数比是1:1
D.NaCl固体不能导电,是因为固体中不存在阴阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的说法中错误的是( )
A. 甲烷分子是由极性键构成的分子 B. 甲烷分子具有正四面体结构
C. 甲烷分子中四个C—H 是完全等价的键 D. 甲烷分子中具有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的反应为N2+3H2![]() 2NH3+Q。下表是某次反应时NH3的浓度变化:
2NH3+Q。下表是某次反应时NH3的浓度变化:
时间(min) | 0 | 5 | 10 | 15 | 20 |
c(NH3)(mol/L) | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
完成下列填空:
(1)由表中数据计算0~10 min时,用H2表示的平均反应速率为________________。降低温度,反应的平衡常数将______________(填“增大”、“减小”或“不变”)。若要增大反应速率且提高H2利用率,可采取的措施有________________。
(2)若反应中气体混合物的密度保持不变,能否说明该反应已经达到平衡状态?并说明理由。____________________________________________________________________
(3)用右图所示装置进行有关氨气性质的实验,挤出胶头滴管中的水,打开止水夹后的实验现象是_____________。

(4)氨气溶于水后溶液显碱性的原因是(用方程式表示)____________________________________________。若在氨水中逐滴滴加盐酸,则溶液的pH将__________(填“增大”、“减小”或“不变”);当恰好完全反应时,则c(NH4+)________c(Cl-)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CrO42-+2H+![]() Cr2O72-+H2O。25℃时,调节初始浓度为1.0mol·L-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如下曲线。下列说法不正确的是( )
Cr2O72-+H2O。25℃时,调节初始浓度为1.0mol·L-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如下曲线。下列说法不正确的是( )

A. 平衡时,pH越小,c(Cr2O72-)越大
B. A、B两点c(CrO42-)之比为5:2
C. B点CrO42-的平衡转化率为40%
D. 平衡时,若溶液中c(CrO42-)=2c(Cr2O72-),则c(H+)=1.0×10-7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列组成活细胞的基本元素中,含量由多到少的正确顺序是( )
A. C>H>O>N B. C>O>H>N
C. O>C>N>H D. O>C>H>N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家成功开发出便携式固体氧化物燃料电池,它以丙烷气体为燃料,空气为氧化剂,电解质是固态氧化物,在熔融状态下能传导O2﹣; 该电池的总反应是C3H8+5O2═3CO2+4H2O,负极反应为C3H8﹣20e﹣+10O2﹣═3CO2+4H2O.下列关于该燃料电池的说法中正确的是( )
A.在熔融电解质中,O2﹣由负极移向正极
B.电池的正极通入丙烷
C.电路中每通过5 mol 电子,约有5.6 L标准状况下的丙烷被完全氧化
D.在电池正极的电极反应为O2﹣4e﹣═2O2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
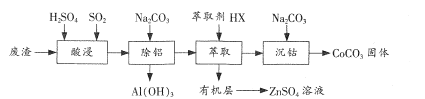
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)

(1)“酸浸”时通入SO2的目的是__。
(2)“除铝”时调节溶液pH范围为__,该过程中主要反应的离子方程式为__。
(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是__。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是__。
(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 __。
(5)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为_______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com