
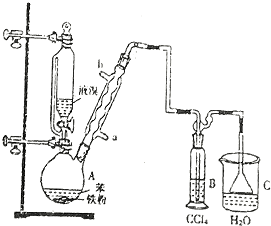
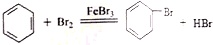 .
.分析 根据实验装置图可知,在装置A中用苯与溴在铁粉作催化剂的条件下生成溴苯和溴化氢,由于苯和液溴都是易挥发的物质,为了提高原料的利用率,用球形冷凝管进行冷凝回流,生成的溴化氢气体中含有少量的溴蒸,用B装置中的四氯化碳除去溴化氢中的溴蒸汽,在装置C中用水吸收生成的溴 化氢,由于溴化氢极易溶于水,所以在用水吸收溴化氢的时候用防倒吸装置,
(1)A中用苯与溴在铁粉作催化剂的条件下生成溴苯和溴化氢;
(2)B装置的目的是除去溴化氢中的溴蒸气;
(3)冷凝管的防止苯和溴的挥发,根据逆流的冷却效果好判断进水口;
(4)根据上面的分析可知,C中是用水吸收的溴化氢,能与硝酸银溶液反应生成浅黄色沉淀,溴化氢溶液呈酸性能使石蕊试纸变红;
(5)得到粗溴苯中含有苯、溴、溴化铁等杂质,要先用水洗除溴化铁,再用碱洗除溴,再水洗除碱等,再干燥、蒸馏除苯,据此答题.
解答 解:(1)A中用苯与溴在铁粉作催化剂的条件下生成溴苯和溴化氢,反应的方程式为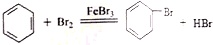 ,
,
故答案为: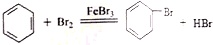 ;
;
(2)B装置的目的是除去溴化氢中的溴蒸气,溴易溶于四氯化碳,所以B中盛放的CCl4的作用是除去溴化氢气体中的溴蒸气,
故答案为:除去溴化氢气体中的溴蒸气;
(3)冷凝管的防止苯和溴的挥发,提高原料的利用率,所以冷凝管的作用是冷凝回流,冷却时冷水从下面进上面出,这样的冷却效果好,所以进水口为a,
故答案为:冷凝回流; a;
(4)证明苯和液溴发生的是取代反应而不是加成反应,即证明有溴化氢产生即可,所以加入硝酸银溶液后溶液中有浅黄色沉淀产生,或者用蓝色石蕊试纸检验溴化氢的存在,
故答案为:有淡黄色沉淀生成;蓝色石蕊试纸;
(5)得到粗溴苯中含有苯、溴、溴化铁等杂质,要先用水洗除溴化铁,再用碱洗除溴,再水洗除碱等,再干燥、蒸馏除苯,所以实验的正确的操作顺序是②④②③①,
故选b.
点评 本题考查有机物实验制备,涉及溴苯的制取,侧重考查学生对装置与原理的分析评价,明确各个装置的作用及基本操作方法,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物总能量为679kj | |
| B. | 生成物总能量为431kj | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应放出183kJ能量 | |
| D. | 氢气和氯气反应生成2mol氯化氢气体,反应吸收183kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如图中的每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种.
如图中的每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com