
【题目】铜是有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域,铜的冶炼和加工对于现代社会有着重要的意义。
(1)工业上可用黄铜矿冶炼粗铜,简要流程如下:
![]()
在转炉中,经过两步反应生成粗铜,其的热化学方程式分别为:
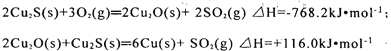
则总反应的热化学方程式为:_______________________________________;
(2)粗铜可用电解法精炼,电解过程中,粗铜应做____极;精铜一侧电极反应式为__________;
(3)电解精炼时粗铜中Fe、Zn等杂质元素会进入电解质溶液,一段时间后需要对电解液除杂净化,其中除去铁元素的一种操作如下:
![]()
下表为部分阳离子以氢氧化物形式沉淀时溶液的pH:

①试剂a是_______________,其作用是_________________________________________;
②溶液A加入CuO调节pH的目的是________________________________________(用必要的离子方程式和适当的文字说明)。
③操作①名称是________________。
(4)电解槽阳极泥中含有Ag、Au等贵金属,分离提纯Au的工艺流程如下:
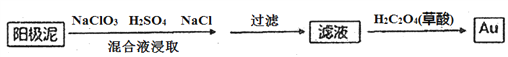
①滤液中Au元素的存在形式为[AuC14]-,写出浸取步骤反应的离子方程式________________。
②加入草酸后,滤液中发生氧化还原反应,生成Au单质,该反应中氧化剂和还原剂的物质的量之比为____________。
【答案】 Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) ΔH=-217.4kJmol-1 阳极 Cu2+ + 2e- = Cu H2O2(或O2、O3等) 将Fe2+氧化为Fe3+,有利于后续反应除杂 Fe3+ + 3H2O![]() Fe(OH)3 + 3H+,CuO + 2H+ = H2O + Cu2+ ,CuO反应氢离子使Fe3+的水解平衡向右移动,生成Fe(OH)3沉淀 过滤 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O 2:3
Fe(OH)3 + 3H+,CuO + 2H+ = H2O + Cu2+ ,CuO反应氢离子使Fe3+的水解平衡向右移动,生成Fe(OH)3沉淀 过滤 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O 2:3
【解析】(1)据盖斯定律,将所给两式相加得:3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g)△H=(-768.2kJmol-1+116.0kJmol-1)=-652.2kJ/mol,再除以3得:Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.4kJ/mol;答案为:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) ΔH=-217.4kJmol-1
(2)粗铜主要发生反应为:Cu-2e-═Cu2+,发生氧化反应,阳极发生氧化反应,故粗铜做阳极;精铜做阴极发生还原反应,电极反应式为:Cu2+ + 2e- = Cu ;答案为:阳极 Cu2+ + 2e- = Cu
(3)①根据表中数据发现当三价铁离子形成沉淀时,铜离子不沉淀,可以将亚铁离子氧化为三价铁,再调节PH来除去亚铁离子,所以可以选择氧化剂双氧水或O2 、O3等,; ②加入CuO发生反应:CuO + 2H+ = H2O + Cu2+消耗Fe3+ + 3H2O≒Fe(OH)3 + 3H+产生的H+,使Fe3+的水解平衡向右移动,生成Fe(OH)3沉淀③可用过滤的方法除去沉淀,所以操作①是过滤。答案为:①H2O2(或O2 、O3等)、将Fe2+氧化为Fe3+,有利于后续反应除杂② Fe3+ + 3H2O≒Fe(OH)3 + 3H+,CuO + 2H+ = H2O + Cu2+ ,CuO反应氢离子使Fe3+的水解平衡向右移动,生成Fe(OH)3沉淀 ③过滤
(4)①单质Au在酸性环境下与NaClO3、NaCl反应生成![]() ,反应的离子方程式: 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O ② 加入草酸后[AuCl4]- 得到Au单质作氧化剂,草酸中的碳被氧化为CO2作还原剂,根据得失电子数相等可得氧化剂与还原剂的物质的量之比为:2:3.答案为:① 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O ②2:3
,反应的离子方程式: 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O ② 加入草酸后[AuCl4]- 得到Au单质作氧化剂,草酸中的碳被氧化为CO2作还原剂,根据得失电子数相等可得氧化剂与还原剂的物质的量之比为:2:3.答案为:① 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O ②2:3


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是 ( )
A. K+、Na+、HCO3-、NO3- B. Na+、SO42-、Cl-、S2-
C. NH4+、Mg2+、SO42-、NO3- D. H+、K+、Cl-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已准确称量过的氢氧化钠固体配制0.20 mol·L-1的氢氧化钠溶液250 mL,要用到的仪器是( )
①250 mL容量瓶 ②托盘天平 ③烧瓶 ④胶头滴管 ⑤烧杯 ⑥玻璃棒 ⑦试管 ⑧药匙
A. ①④⑤⑥ B. ①②④⑤
C. ①②④⑤⑥⑧ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式错误的是( )
A.向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
C.氢氧化铝与足量盐酸反应 Al(OH)3+3H+=Al3++3H2O
D.过量CO2通入氢氧化钠溶液中 CO2+2OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. HF、HCl、H2S、PH3的稳定性依次增强
B. 按Mg、Si、N、F的顺序,原子半径由小变大
C. 某主族元素的电离能I1~I7数据如下表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族

D. 在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现下列物质之间的转化,需要加入还原剂才能实现的是( )
A. HCl→Cl2 B.Cl2→HClOC.Na→Na2OD.CuSO4 → Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18g·mL-1,其中镁离子的质量分数为5.1%。300mL该溶液中Cl—的物质的量约为
A. 0.37mol B. 0.63mol C. 0.74mol D. 1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
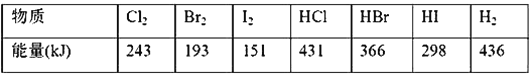
(1)下列物质本身具有的能量最低的是(____)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是(____)
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应? _____________。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com