
| A. | 该合金中铜与镁的物质的量之比是1:2 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | NO2和N2O4的混合气体中,NO2的体积分数是80% | |
| D. | 得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL |
分析 A.金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,根据n=$\frac{m}{M}$计算氢氧根的物质的量,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,根据提供的电子物质的量与二者质量之和列方程计算x、y的值,据此解答;
B.根据c=$\frac{1000ρw}{M}$计算该浓硝酸的物质的量浓度;
C.根据n=$\frac{V}{Vm}$计算NO2和N2O4混合气体的物质的量,令二氧化氮的物质的量为amol,根据电子转移列方程计算;
D.反应后溶质为硝酸钠,根据氮元素守恒计算硝酸钠的物质的量,根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=$\frac{n}{c}$计算需要氢氧化钠溶液的体积.
解答 解:A.金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,氢氧根的物质的量为$\frac{1.02g}{17g/mol}$=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{2x+2y=0.06}\\{64x+24y=1.52}\end{array}\right.$,解得x=0.02,y=0.01,故合金中铜与镁的物质的量之比是0.02mol:0.01mol=2:1,故A错误;
B.该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,故B正确;
C.NO2和N2O4混合气体的物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,NO2和N2O4 的物质的量之比=0.04mol:(0.05mol-0.04mol)=4:1,NO2的体积分数是$\frac{4}{4+1}$×100%=80%,故C正确;
D.反应后溶质为硝酸钠,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=0.64mol,故需要氢氧化钠溶液的体积为$\frac{0.64mol}{1mol/L}$=0.64L=640mL,故D正确;
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
 M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol/L 的稀硫酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 合成氨的反应是一个放热反应,所以升高温度,反应速率减慢 | |
| C. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| D. | 汽车尾气中的 CO 和 NO 可以缓慢反应生成 N2和 CO2,减小压强,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
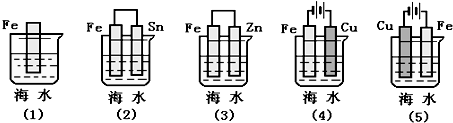
| A. | (5)(2)(1)(3)(4) | B. | (5)(1)(2)(4)(3) | C. | (4)(2)(1)(3)(5) | D. | (4)(3)(1)(2)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+) 由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫磺和硫蒸气分别完全燃烧放出的热量 | |
| B. | 中和体积与pH都相等的醋酸溶液和盐酸所消耗的NaOH的物质的量 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2,两个反应热△H的大小 | |
| D. | 相同温度、相同浓度的NH4Cl和NH4HSO4溶液中c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | bd | B. | bc | C. | ad | D. | 只有d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
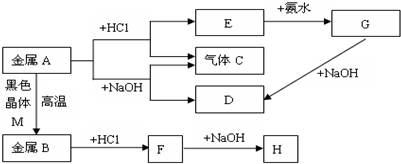
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com