
A、B、C、D、E、F为原子序数依次增大的主族元素。已知A、C、F三原子的最外层共有12个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3。回答:
(1)写出下列元素的符号:A________、D________、E________;
(2)用电子式写出B、F形成的化合物的电子式___________________;(3)A、C两种元素最高价氧化物的水化物反应的离子方程式为__________________________;(4)D的固态氧化物是_______晶体,含n molD的氧化物的晶体中含D—O共价键为_______mol。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
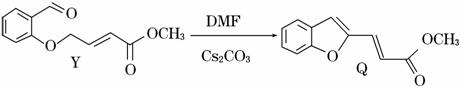
具有抗HIV、抗肿瘤、抗真菌和延缓心血管老化的活性苯并呋喃衍生物(Q)的合成路线如下:
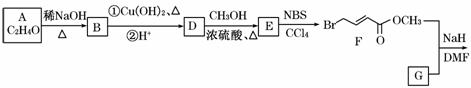
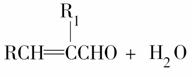
已知:RCHO+R1CH2CHO
(R、R1表示烃基或氢)
(1)①A的名称是________。
②D→E的反应类型是________。
③F中含有的官能团有酯基、________和________(写名称)。
④写出F与足量NaOH溶液共热反应的化学方程式:
_________________________________________________________________________。
(2)物质G可通过如下流程合成:
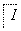
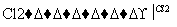

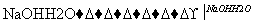


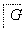
1.08 g的I与饱和溴水完全反应,生成2.66 g白色沉淀,则I的结构简式为________。
写出M→G中反应①的化学方程式: ____________________
_________________________。
(3)下列说法正确的是________(填序号)。
a.Y易溶于水
b.B能使酸性高锰酸钾溶液褪色
c.Q的分子式为C12H10O3
d.I与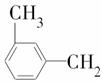 OH互为同系物
OH互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
A是一种可以作为药物的有机化合物。请从下列反应图式中各有机物的关系(所有无机物均已略去),回答下列问题:
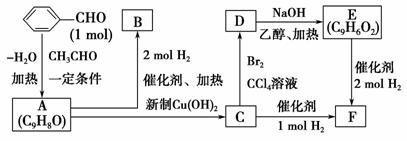
(1)推测有机物A、B、C、E、F的结构简式。
(2)写出下列反应的反应类型:CD: __________________________________;
DE: __________________________________________________________。
(3)写出下列反应的化学方程式:
AB: ____________________________________________________________;
AC: ____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为12,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是
A.原子半径:A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明氯的非金属性比硫强的是 ( )
A.铁与硫反应生成硫化亚铁,而铁与氯气反应时生成氯化铁
B.与金属钠反应,氯原子得一个电子,而硫原子能得两个电子
C.常温时氯气呈气态,而硫呈现固态
D.氯的最高价为+7价,而硫的最高价为+6价
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列条件下,能大量共存的微粒组是 ( )
A.c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32-
B. 右表提供的数据下:HClO 、HCO3-、ClO-、CO32-
C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I-
D.中性的溶液中:CO32-、Na+、SO42-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+F2(g)=2HF(g) ?△H= -270kJ/mol,下列说法正确的是
A.2L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
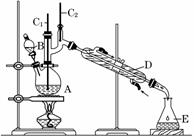
发生的反应如下:
CH3CH2CH2CH2OH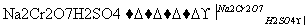 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2 Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0 g。
回答下列问题:
(1)实验中, 能否将Na2Cr2O7溶液加到浓硫酸中,说明理由______________________。
能否将Na2Cr2O7溶液加到浓硫酸中,说明理由______________________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是________。
(3)上述装置图中,B仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分离水时,水在________层(填“上”或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com