
【题目】地球上的氮元素对动植物有重要作用,其中氨的合成与应用是当前的研究热点。人工固氮最主要的方法是Haber—Bosch法。通常用以铁为主的催化剂在400~500℃和10~30MPa的条件下,由氮气和氢气直接合成氨。
在Fe催化剂作用下的反应历程为(*表示吸附态):
化学吸附:N2(g)→2N* ;H2(g)→2H*;
表面反应:N*+H*NH*;NH*+H*NH2*;NH2*+H*NH3*;
脱附:NH3*NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
请回答:
(1)已知合成氨反应中生成1 mol NH3放出46kJ热量,该反应的热化学方程式为______
(2)实际生产中,原料气中N2和H2物质的量之比为1:2.8。分析说明原料气中N2过量的理由________。
(3)关于合成氨工艺的下列理解,正确的是____________。
A.合成氨反应在不同温度下的ΔH和ΔS都小于零
B.控制温度远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.原料中N2由分离空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防止催化剂中毒和安全事故发生
(4)已知反应:![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)标准平衡常数
H2(g)NH3(g)标准平衡常数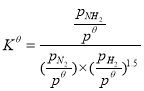 ,其中
,其中![]() 为标准压强(1×105Pa),
为标准压强(1×105Pa),![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如:
为各组分的平衡分压,如:![]() =
=![]() ,p为平衡总压,
,p为平衡总压,![]() 为平衡系统中NH3的物质的量分数。
为平衡系统中NH3的物质的量分数。
若N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,N2的平衡转化率为![]() ,则
,则![]() =_________(用含
=_________(用含![]() 的最简式表示)。
的最简式表示)。
(5)常温常压下电解法合成氨的原理如图所示:
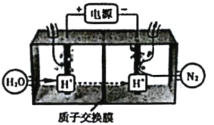
①阴极生成氨的电极反应式为__________。
②阳极产物只有O2,电解时实际生成的NH3的总量远远小于由O2理论计算所得NH3的量,结合电极反应式解释原因:___________________。
【答案】N2(g)+3H2(g)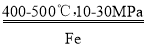 2NH3(g) △H=-92kJ﹒mol-1 原料气中N2:相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率。 ACD
2NH3(g) △H=-92kJ﹒mol-1 原料气中N2:相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率。 ACD ![]() N2+6H++6e-=2NH3 还可能发生2H++2e-=H2↑,N2+8H++6e-=2NH4+
N2+6H++6e-=2NH3 还可能发生2H++2e-=H2↑,N2+8H++6e-=2NH4+
【解析】
(1)已知合成氨反应中生成1 mol NH3放出46kJ热量,则2mol NH3放出92 kJ热量,该反应的热化学方程式为N2(g)+3H2(g)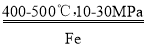 2NH3(g) △H=-92kJ﹒mol-1 ,故答案为:N2(g)+3H2(g)
2NH3(g) △H=-92kJ﹒mol-1 ,故答案为:N2(g)+3H2(g)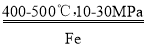 2NH3(g) △H=-92kJ﹒mol-1 ;
2NH3(g) △H=-92kJ﹒mol-1 ;
(2)实际生产中,原料气中N2和H2物质的量之比为1:2.8。原料气中N2过量的理由原料气中N2,相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率。故答案为:原料气中N2,相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率;
(3)A.合成氨反应是气体体积减小的放热反应,在不同温度下的ΔH和ΔS都小于零,故A正确;
B.控制温度远高于室温,是为了保证催化剂活性最高,故B错误;
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,减小生成物浓度,利于反应正向进行,故C正确;
D.原料中N2由分离液态空气得到,H2由天然气与水蒸气反应生成,原料气需要经过净化处理,以防止催化剂中毒和安全事故发生,故D正确;
故答案为:ACD;
(4)若N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,N2的平衡转化率为![]() ,
,
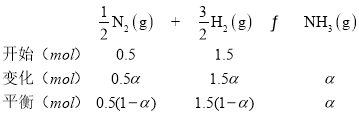
平衡混合气体总物质的量=[0.5(1-a)+1.5(1-a)+a]mol=(2-a)mol,p为平衡时压强,p(N2)=![]() ,p(H2)=
,p(H2)=![]() ,p(NH3)=
,p(NH3)=![]() ,Kθ=
,Kθ=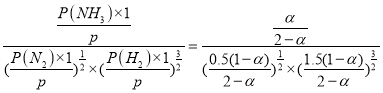 ,则Kθ=
,则Kθ=![]() (用含
(用含![]() 的最简式表示)。故答案为:
的最简式表示)。故答案为:![]() ;
;
(5)①阴极与电源负极相连,为N2放电生成NH3,阴极生成氨的电极反应式为N2+6H++6e-=2NH3 ;故答案为:N2+6H++6e-=2NH3 ;
②电解时实际生成的NH3的总量远远小于由O2理论计算所得NH3的量,原因是电解时,阴极除了N2得电子外,还可能发生N2+8H++6e-=2NH4+,2H++2e-=H2。故答案为:还可能发生2H++2e-=H2↑,N2+8H++6e-=2NH4+。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】已知Fe3O4可表示成FeO·Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O。下列说法正确的是( )
A.O2和S2O32-是氧化剂,Fe2+是还原剂
B.参加反应的氧化剂与还原剂的物质的量之比为1∶5
C.每生成1molFe3O4,转移电子的物质的量为2mol
D.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2 =2AB的能量变化如图所示。下列说法正确的是( )
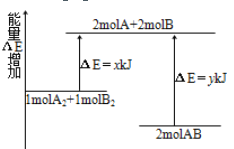
A. 该反应是吸热反应
B. 2 mol A—B键断裂需要吸收y kJ 的能量
C. 1 mol A—A键和1mol B—B键断裂能放出x kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。

已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)[CuCl3]2-(aq)(无色溶液)。下列叙述正确的是
A.“浸取”过程中的主要反应为CuFeS2+4CuCl2=4CuCl+FeCl2+2S
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s) +2Cl-(aq)[CuCl3]2-(aq)平衡逆向移动,析出CuCl,Cl-浓度增大
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,CO和水蒸气分别为1 mol、3 mol,在密闭容器中发生反应CO+H2O(g)![]() CO2+H2,达平衡后测得CO2为0.75 mol,再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为
CO2+H2,达平衡后测得CO2为0.75 mol,再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为
A. 1.2 mol B. 1.8 mol C. 2.5 mol D. 1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验:
(1)向第一份中加入AgNO3溶液,有沉淀产生;
(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
(3)向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。 根据上述实验现象,以下推测正确的是
A. K+不一定存在 B. Ba2+、Mg2+不一定都存在
C. Cl-不一定存在 D. 混合溶液中CO32-的浓度为0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示, 已知:ICl中氯为-1价,碘为+1价。下列有关说法正确的是
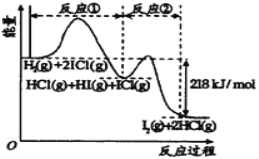
A.反应①为吸热反应
B.反应①和②均是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能有关
D.HI(g)+ICl(g) ![]() I2(g)+HCl(g) △H=-218 kJ/mol
I2(g)+HCl(g) △H=-218 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A. 反应需在300 ℃进行可推测该反应是吸热反应
B. 使用催化剂可提高反应速率
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com