
分析 ①钠和水反应生成氢氧化钠和氢气;
②高温下,铁和水蒸气反应生成四氧化三铁和氢气;
③氢氧化铝和氢氧化钠溶液的反应生成偏铝酸钠和水;
④偏铝酸钠溶液中通入过量盐酸反应生成氯化铝、氯化钠和水,结合溶于水的强电解质写成离子,来书写离子方程式.
解答 解:①钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
②高温下,铁和水蒸气反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
③氢氧化铝和氢氧化钠溶液的反应生成偏铝酸钠和水,离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
④偏铝酸钠溶液中通入过量盐酸反应生成氯化铝、氯化钠和水,反应的化学方程式为:NaAlO2+4HCl=NaCl+AlCl3+2H2O,结合溶于水的强电解质写成离子,反应的离子方程式为:AlO2-+4H+=Al3++2H2O,
故答案为:AlO2-+4H+=Al3++2H2O.
点评 本题考查化学方程式、离子方程式书写方法和注意问题,反应的实质和产物判断是解题关键,注意偏铝酸钠溶液加入盐酸,开始生成氢氧化铝沉淀,氢氧化铝是两性氢氧化物,溶于强酸,题目较简单.


科目:高中化学 来源: 题型:选择题
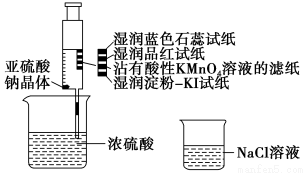
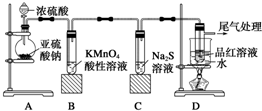
| A. | 蓝色石蕊试纸先变红后褪色 | |
| B. | 品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性 | |
| C. | 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2 | |
| D. | NaCl溶液可用于除去实验中多余的SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
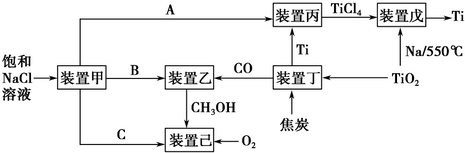
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
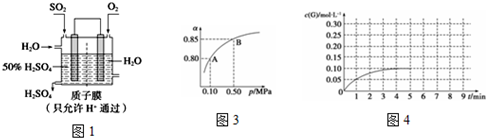
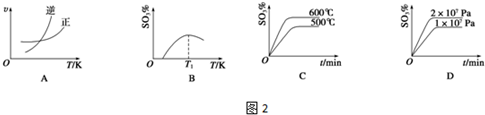
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一种气体通入品红溶液,溶液褪色,说明该气体一定是二氧化硫 | |
| B. | K+、NH4+、SO42-、CO32-离子组在加入铝粉能放出大量H2的溶液中一能能大量共存 | |
| C. | FeBr2溶液中通入过量Cl2时的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 在纯碱溶液中逐滴加入稀盐酸时,开始没有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
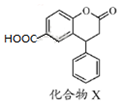
| A. | X的分子式为C16H11O4 | |
| B. | X分子中有三种不同的官能团 | |
| C. | 1 mol化合物X最多能与3 mol NaOH反应 | |
| D. | X分子中两个苯环一定处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 用铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中无K+ |
| B | 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 | 溶液中一定含有SO42- |
| C | 向一定浓度的CuSO4溶液中通入适量H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com