
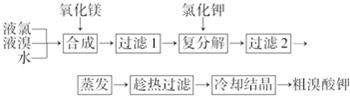
分析 氯气具有氧化性,在水中和溴单质反应生成溴酸和氯化氢,加入过量氧化镁和盐酸溴酸反应生成氯化镁和溴酸镁,过滤得到滤液中加入饱和氯化钾溶液,氯化镁在饱和溶液中析出晶体,过滤得到滤液为溴酸钾溶液,蒸发浓缩,冷却结晶,为得到更多晶体趁热过滤得到晶体溴酸钾.
(1)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,液氯、液溴和氧化镁反应生成Mg(BrO3)2、MgCl2;
(2)在滤液中加入氯化钾,溴酸镁和氯化钾发生复分解反应生成氯化镁沉淀和溴酸钾;
(3)第二次过滤是在溴酸镁和氯化钾发生复分解反应之后,所以沉淀为氯化镁;
(4)固体溶解度通常随着温度的升高而升高;
(5)溴酸钾受热易分解,但食品中的溴酸钾油炸和烘焙不一定完全分解.
解答 解:液氯、液溴和氧化镁反应生成Mg(BrO3)2、MgCl2,过滤后在滤液中加入氯化钾可得到KBrO3,发生Mg(BrO3)2+2KCl=MgCl2↓+2KBrO3,氯化镁结晶析出,滤液中KBrO3经蒸发、结晶可得到KBrO3.
(1)液氯、液溴和氧化镁反应生成Mg(BrO3)2、MgCl2,反应的方程式为6MgO+Br2+5Cl2=Mg(BrO3)2+5MgCl2,Cl(0→-1),Br(0→+5),氧化剂是Cl2,还原剂是Br2,
故答案为:Cl2;Br2;6MgO+Br2+5Cl2=Mg(BrO3)2+5MgCl2;
(2)在滤液中加入氯化钾可得到KBrO3,发生Mg(BrO3)2+2KCl=MgCl2↓+2KBrO3,氯化镁结晶析出,
故答案为:Mg(BrO3)2+2KCl=MgCl2↓+2KBrO3;
(3)Mg(BrO3)2+2KCl=MgCl2↓+2KBrO3,氯化镁在饱和溶液中析出晶体,过滤得到滤液为溴酸钾溶液,所以第二次过滤滤出的固体主要成分是MgCl2,
故答案为:MgCl2;
(4)生产溴酸钾,“趁热过滤”过程中“趁热”防止溴酸钾结晶析出,造成晶体损失,
故答案为:防止溴酸钾结晶析出;
(5)油炸薯片中添加溴酸钾受热易分解:2KBrO3$\frac{\underline{\;\;△\;\;}}{\;}$2KBr+3O2↑,所以有关国家认为添加溴酸钾安全,但油炸和烘焙的温度条件不能保证溴酸钾完全分解,所以我国认为不安全,
故答案为:2KBrO3$\frac{\underline{\;\;△\;\;}}{\;}$2KBr+3O2↑;油炸和烘焙的温度条件不能保证溴酸钾完全分解.
点评 本题考查了溴酸钾制备实验过程分析判断,试剂选择的原则和作用理解应用,注意物质性质掌握,题干信息应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加入少量NH4Cl固体,平衡逆移溶液中c(NH4+)减小 | |
| B. | 加入少量浓盐酸,浓盐酸与 NH3•H2O反应,电离平衡逆移 | |
| C. | 加热,电离平衡逆移 | |
| D. | 加水后,溶液中n(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成元素相同,分子结构不同 | |
| B. | 组成元素的质量分数相同,只有化学性质不同 | |
| C. | 具有相同分子量而结构不同 | |
| D. | 具有相同分子量,且组成元素及组成元素的质量分数相同,只是结构不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

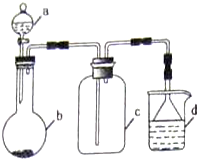
| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Fe | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
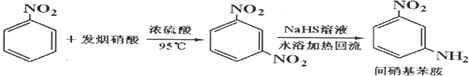
| 参考数据 | 组分 | 邻硝基苯胺 | 间硝基苯胺 | 对硝基苯胺 | 水 | 甲醇 | 硝基苯 |
| 沸点/℃ | 284 | 305.7 | 331.7 | 100 | 64.7 | 4.75 | |
| 偶极矩/D | 4.38 | 4.91 | 6.33 | 1.85 | 1.69 | 4.75 | |
| 颜色 | 橙色 | 淡黄色 | 淡黄色 | 无色 | 无色 | 淡黄色 |

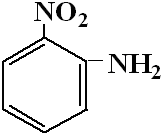 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液与稀硫酸反应 | B. | Ba(OH)2溶液与Na2SO4溶液反应 | ||
| C. | Ba(OH)2溶液与NaHSO4溶液反应 | D. | Ba(NO3)2溶液与MgSO4溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com