


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
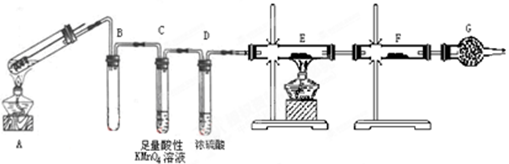
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
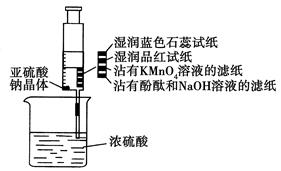
| A.蓝色石蕊试纸先变红后褪色 |
| B.沾有KMnO4溶液的滤纸褪色,证明了SO2的漂白性 |
| C.品红试纸褪色,证明了SO2的漂白性 |
| D.沾有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.④⑤ | B.②④ | C.② | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下都能用铝容器贮存 | B.露置在空气中,容器内酸液的质量都增加 |
| C.常温下都能与铜较快反应 | D.露置在空气中,容器内酸液的质量都减少 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
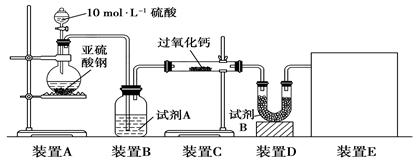
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com