
 ,C元素离子电子式Na+.
,C元素离子电子式Na+. .
.分析 已知A元素的气态氢化物与其最高价氧化物的水化物反应生成该元素的中间价态的物质,则A元素的气态氢化物具有还原性,则A为S元素;B元素与A元素位于同一周期,B元素气态氢化物水溶液是一元酸,则B为Cl元素,HCl与HClO4的分子量之比是1:2.753;C元素与A元素形成C2A型离子化合物,C的阳离子为+1价,而C离子核外含有的电子数与OH-所含电子数相等,即C+含有10个电子,所以C为Na元素;据此分析.
解答 解:已知A元素的气态氢化物与其最高价氧化物的水化物反应生成该元素的中间价态的物质,则A元素的气态氢化物具有还原性,则A为S元素;B元素与A元素位于同一周期,B元素气态氢化物水溶液是一元酸,则B为Cl元素,HCl与HClO4的分子量之比是1:2.753;C元素与A元素形成C2A型离子化合物,C的阳离子为+1价,而C离子核外含有的电子数与OH-所含电子数相等,即C+含有10个电子,所以C为Na元素;
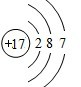
(1)S原子核外6个电子,其电子式为:•$\underset{\stackrel{••}{S}}{••}$•;B为Cl元素,其质子数为17,核外有17个电子,最外层电子数为7,其原子的结构示意图 ;Na+的离子符号即是其电子式:Na+;
;Na+的离子符号即是其电子式:Na+;
故答案为:•$\underset{\stackrel{••}{S}}{••}$•; ;Na+;
;Na+;
(2)硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为: ;
;
故答案为: ;
;
(3)元素的非金属性越强,其单质氧化性越强,其氢化物越稳定,S的氧化性小于氯气,即S元素的单质氧化性比Cl元素单质的氧化性弱;S元素的氢化物比Cl元素的氢化物对热的稳定性弱;
故答案为:弱;弱.
点评 本题考查元素周期表、元素周期律、元素化合物的性质等,难度中等,注意整体把握元素周期表的结构,推断出具体的元素是解决本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 铝常温下不与氧气反应 | |
| B. | 铝常温下不与浓硫酸反应产生气体,是因为发生钝化 | |
| C. | 向氯化铝溶液中逐滴加入氨水的现象是先产生白色沉淀,后白色沉淀又溶解 | |
| D. | 氧化铝只能与酸反应,不能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 68.76 kJ | B. | 57.3 kJ | C. | 34.38 kJ | D. | 17.19 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液吸收少量CO2 CO2+OH-=CO32-+H2O | |
| B. | 盐酸滴在铜片上 Cu+2H+=Cu2++H2O | |
| C. | H2SO4与Ba(OH)2溶液反应 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| D. | CaCl2溶液中通入CO2 Ca2++CO2+H2O=CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,现有浓度都为0.1mol•L-1HX、HY的溶液各20ml,分别用0.1mol•L-1NaOH溶液滴定.溶液的pH与加入NaOH溶液体积V的关系如图所示.
常温下,现有浓度都为0.1mol•L-1HX、HY的溶液各20ml,分别用0.1mol•L-1NaOH溶液滴定.溶液的pH与加入NaOH溶液体积V的关系如图所示.| A. | 滴定过程中,水电离的c(H+)•c(OH-)均不变 | |
| B. | HX的电离程度小于HY的电离程度 | |
| C. | V=10ml时,c(HX)+c(X-)=2c(Na+) | |
| D. | V=20ml时,c(Y-)>c(X-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
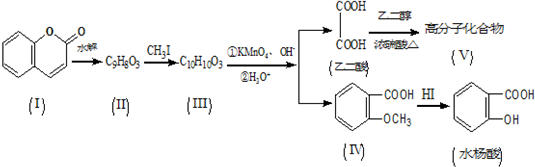
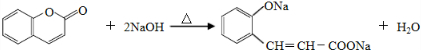 .
.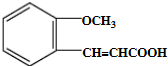 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | 物质微粒数 | 标准状况下气体摩尔体积 | 固体体积 | 溶液的质量分数 | 非标准状况下物质的质量 |
| 乙 | 阿伏加德罗常数 | 标准状况下气体体积 | 固体密度 | 溶液的体积 | 物质的摩尔质量 |
| A. | ②④ | B. | ④⑤ | C. | ③④ | D. | ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com