
【题目】下列有关叙述正确的是
A. 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B. 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4FeOH)3(s)能自发进行,则△H<0
C. NH4Al(SO4)2溶液中加入少量氢氧化钠溶液:NH4++OH-=NH3·H2O
D. 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
科目:高中化学 来源: 题型:
【题目】某学生用含氯气的不合格蒸馏水去配制下列物质的溶液,不会产生明显的药品变质问题的是
A. Na2SO3 B. KI C. AgNO3 D. BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 ![]() H、
H、 ![]() H、
H、 ![]() H、H+、
H、H+、 ![]() H2、
H2、 ![]() H2的说法,正确的是( )
H2的说法,正确的是( )
A.是氢元素的五种核素
B.![]() H2、
H2、 ![]() H2互称为同素异形体
H2互称为同素异形体
C.![]() H、
H、 ![]() H、
H、 ![]() H互称为同位素
H互称为同位素
D.![]() H、
H、 ![]() H、
H、 ![]() H的化学性质不同
H的化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与氨碱法比较,下列关于联合制碱法优点的判断中不正确的是( )
A.提高了原料的原子利用率
B.降低了生产成本
C.减少了环境污染
D.减轻了对设备的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中ffi重要试剂,可由NO与Cl2在常温常压(或稍低温度)下合成,其熔点-64.5℃,沸点-5.5℃,遇水易水解。实验室模拟制备装置如图所示(部分夹持装置省略),D中三颈烧瓶置于-10℃冰盐水中。

经查阅资料:NO与NaOH溶液不反应,但NO2+NO+2NaOH =2NaNO2+H2O
(1)仪器甲的名称是________。
(2)图示装置中恒压漏斗与分液漏斗相比,其优点为___________。
(3) NOC1分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。
(4)实验开始时,先打开K1、K2,关闭K3,打开分液漏斗活塞滴入适量稀硝酸,至C中红棕色完全消失后,关闭K1、K2,此时装置C的作用为___________。滴入适量浓盐酸,点燃酒精灯,当_______(填装置符号)中充满黄绿色气体时,打开K1、K3,制备NOC1。

(5)装置乙中装有无水CaCl2,其作用为_______;丙为尾气处理装置,则最佳选择为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认识反应条件对化学反应的影响,对学好化工生产知识具有重要意义。下列说法不正确的是 ( )。
A.SO2合成SO3虽然属于放热反应,但工业上合成SO3时仍需加热
B.合成氨工业采用高温高压和使用催化剂,因这些条件都符合化学平衡原理
C.合成纯碱的过程中,应首先向饱和食盐水中通入NH3 , 再通入足量CO2
D.通过加压降温的方法可获得制备NH3的原料气N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂试剂和方法均正确的是( )
选项 | 物质 | 除杂试剂 | 除杂方法 |
A | 乙烷中混有乙烯 | H2 | 催化剂、加热 |
B | 乙醇中混有乙酸 | 饱和Na2CO3溶液 | 分液 |
C | 苯中混有苯酚 | 足量浓溴水 | 过滤 |
D | 丙醇中混有水 | CaO | 蒸馏 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
(1)Ⅰ.将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应的速度最慢;与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为
(3)将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH碱性强于NH3H2O,继而可以验证Na的金属性强于氮,你认为此设计是否合理?并说明理由. .
(4)Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律 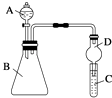
仪器B的名称为 , 干燥管D的作用为 .
(5)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液(填现象),即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个容积均为2L的密闭容器中发生反应:2HI(g)H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
(1)实验1和实验2中使用了催化剂的实验是(填“1”或“2”);
(2)实验1中,0l0min内生成H2的平均反应速率为molL﹣1min﹣1;
(3)实验3的反应达到化学反应限度时,HI(g)转化率为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com