
【题目】25 °C时,用氢氧化钠调节浓度为2.0×10-3mol L-1的氢氟酸溶液的pH (忽略体积 变化),溶液中c(HF)、c(F- )与pH的变化关系如下图所示。下列说法不正确的是
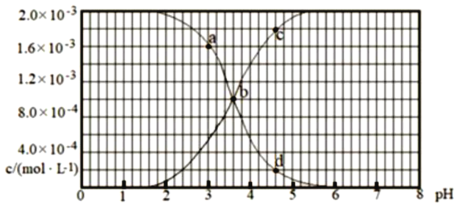
A. abd曲线代表c(F-)随pH的变化
B. 25 °C时,HF电离平衡常数的数值Ka=10-3.6
C. 从b点到c点发生的离子反应方程式是:HF + OH- = H2O+ F-
D. 图中a点溶液粒子浓度大小是:c(HF)>c(H+)>c(F-)>c(OH-)
【答案】A
【解析】
氢氟酸溶液中加入氢氧化钠,随着氢氧化钠的量的增加,溶液的pH升高,溶液中的氟化氢分子浓度减小,氟离子浓度增大。A. abd曲线代表c(HF)随pH的变化,故错误;
B.从图中b点分析,氟化氢的电离平衡常数= ![]() =10-3.6,故正确;
=10-3.6,故正确;
C. 从b点到c点发生的反应为氢氧化钠和氟化氢的反应,离子方程式为:HF + OH- = H2O+ F-,故正确;
D. 从图中a点分析,氟化氢的浓度比氟离子浓度大,氟化氢的浓度为1.6×10-3 mol/L,氢离子浓度为1.0×10-3mol/L,而氟离子浓度约为5.5×10-4mol/L,溶液显酸性,所以溶液粒子浓度关系为:c(HF)>c(H+)>c(F-)>c(OH-),故正确。
故选A。


科目:高中化学 来源: 题型:
【题目】海带含有丰富的碘,为了从海带中提取碘,设计并进行以下实验。
海带![]() 海带灰
海带灰![]() 悬浊液
悬浊液![]() 含
含![]() 的溶液
的溶液![]() 含
含![]() 的溶液
的溶液![]() 含
含![]() 的有机溶液
的有机溶液![]() 晶体碘
晶体碘
(1)步骤a灼烧海带时,不需要用到的仪器是____(选填编号)。
a. b.
b.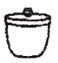 c.
c.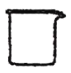 d.
d.
步骤b将所得海带灰加水溶解,所需的玻璃仪器是________。
(2)步骤c的操作名称是__________;
(3)通氯气所发生反应的化学方程式是________;
(4)步骤d的操作名称是______;若加了四氯化碳,____(填:上或下)层呈紫红色。
(5)四氯化碳能从碘水中萃取出碘的原因是①碘在四氯化碳中的溶解度比在水中的溶解度____(填:大或小);②四氯化碳与水___(填:互溶或互不相溶)。不能用酒精代替四氯化碳的理由是______。
(6)证明某未知无色溶液中含有![]() ,写出一种方案:选用试剂__________,现象__________。(参考试剂:氯水、淀粉溶液、四氯化碳、硝酸、硝酸银溶液)
,写出一种方案:选用试剂__________,现象__________。(参考试剂:氯水、淀粉溶液、四氯化碳、硝酸、硝酸银溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中探究二氧化氮与过氧化钠的反应。二氧化氮溶于浓硫酸(硫酸沸点为338℃),加热后NO2可逸出。(本题实验装置省略夹持仪器)
(1)制备NO2的装置如图所示:
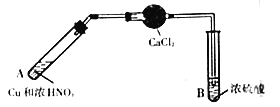
①A中发生反应的化学方程式是___________。
②干燥管内CaCl2的主要作用是吸水,吸水的主要目的是___________。
(2)加热B中吸收液,使NO2逸出,待试管充满红棕色气体后再接入装有足量Na2O2固体的试管,如图:
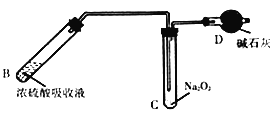
①加热B时,温度不宜过高,原因是___________。
②D中碱石灰的主要作用是___________。
(3)反应后C中固体淡黄色渐渐变白,经分析,反应产物可能有NaNO2、NaNO3,为此,进行如下实验检验:
检验NaNO2:查阅资料可知:NaNO2能使酸性KMnO4溶液褪色。检验过程如下:
取C中固体,加水溶解配制成100mL溶液,加入少量MnO2,振荡静置(记为溶液Q)。取5mL溶液Q,滴加酸性KMnO4溶液,振荡后酸性KMnO4溶液褪色。
①NaNO2使酸性KMnO4,溶液褪色的离子方程式是___________。
②加入少量MnO2的目的是除去剩余Na2O2和水反应产生的H2O2,其化学方程式为______
(4)经检验产物中还含有NaNO3。NO2与Na2O2化合生成NaNO3的化学方程式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
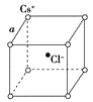
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )
A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)在生产中广泛用作催化剂、杀菌剂、脱色剂。某兴趣小组采用加热分解氯化铜晶体(CuCl2·xH2O)的方法制备CuCl,其装置如下(夹持仪器省略)。

已知:
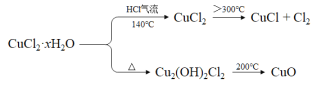
完成下列填空:
(1)在实验过程中,可以观察到C中试纸的颜色变化是___________________________。
(2)实验过程中需要全程通入干燥的HCl,其作用是___________________________。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的杂质,根据已知信息
① 若杂质是CuCl2,则产生的原因可能是____________________________________。
② 若杂质是CuO,则产生的原因可能是_____________________________________。
(4)为测定原料CuCl2·xH2O中结晶水的数目x,可采取如下方案:
a.用电子天平称取一定质量氯化铜晶体 b.在______(填仪器名称)中充分灼烧
c.在干燥器中冷却 d.称量所得黑色固体质量
e.重复b ~ d操作直至_____________________
① 完成上述实验操作步骤。
② 若氯化铜晶体质量为3.384 g,最终得到黑色固体质量为1.600 g,则x =________(精确到0.1)。
③ 若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况。____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验描述、对应的现象以及结论都正确的是( )
选项 | 实验 | 现象 | 结论 |
A | 向滴有酚酞的Na2CO3溶液中加入BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
B | 处理锅炉水垢中的CaSO4 时,依 次加入饱和Na2CO3溶液和盐酸 | 水垢溶解 | Ksp:CaCO3>CaSO4 |
C | 其它条件不变,平衡体系: FeCl3(aq)+3KSCN(aq) +3KCl(aq)中,加KCl 固体 | 红色变浅 | 证明增大生成物KCl的浓度,使原溶液中化学平衡逆向移动 |
D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现 黄色沉淀 | Ksp:AgCl<AgI |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是( )
A. 向Ag2CrO4悬浊液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl
B. 向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Cl-)=c(Ag+)
C. AgCl和Ag2CrO4共存的悬浊液中,![]() =
=![]()
D. 向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,AgCl先析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
B. NaHSO4在水溶液中的电离方程式: NaHSO4= Na++H++SO42-
C. Na2CO3的水解∶CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. NH4Cl的水解:NH4++H2O = NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:Ksp[Fe(OH)3]=4.0×1038,Ksp[Cu(OH)2]=2.2×1020
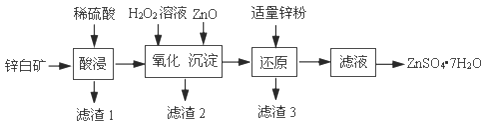
(1)“滤渣1”的主要成分是_______(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②_______(填一种)。
(2)“氧化”过程中,发生氧化还原反应的离子方程式是_______。
(3)“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是_______。
(4)加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×1014mol/L,此时溶液中c(Cu2+)的取值范围是_______mol/L。
(5)加入适量锌粉的作用是_______。
(6)由滤液得到ZnSO47H2O的操作依次为_______、_______、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、_______、_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com