
| A. | 0.1 mol NaCN中含共价键数为0.3NA | |
| B. | 0.1 mol/L NaHCO3溶液HCO3-的数目小于0.1NA | |
| C. | 19 g H218O2含有的中子数为12NA | |
| D. | 上述反应中,当有2.24 L NH3生成时,转移电子数为0.2NA |
分析 NaCN+H2O2+H2O=NaHCO3+NH3↑反应中O元素从-1价降低为-2价,C元素从+2价升高到+4价,结合电子转移和NaCN的性质分析.
解答 解:A、0.1 mol NaCN中含0.1 mol CN-,而碳氮之间是叁键,所以总共价键数为0.3NA,故A正确;
B、体积不知,无法求物质的量,故B错误;
C、1molH218O2含中子的物质的量为20mol,而19 g H218O2的物质的$\frac{19}{38}$mol,所以19 g H218O2含有的中子数为$\frac{19}{38}$×20NA,等于10NA,故C错误;
D、状况不知无法由体积求物质的量,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的相关计算,熟练掌握以物质的量为中心的转化关系,气体摩尔体积的使用条件是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏装置中,温度计水银球的位置在蒸馏烧瓶的支管口处. | |
| B. | “苯甲酸的重结晶”实验步骤是:加热溶解---趁热过滤---冷却结晶---滤出晶体 | |
| C. | 在萃取实验中,溶质在萃取剂中的溶解度小于在原溶剂中的溶解度 | |
| D. | 在过滤实验中,应做到“一贴,二低,三靠” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,Y-的结构式为
,Y-的结构式为 ,Z-的化学式为HF2-.
,Z-的化学式为HF2-.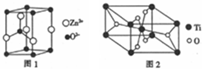
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 氢氧化钠与氯气反应时,生成0.1molNaCl转移的电子数为0.1NA | |
| D. | 一定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实 验 步 骤 及 现 象 | |
| A | 证明氯水有酸性 | 试样$\stackrel{滴加紫色石蕊}{→}$溶液变红色,且长时间不变 |
| B | 检验某红棕色气体是否溴蒸汽 | 试样$\stackrel{滴入淀粉KI溶液}{→}$观察溶液是否变蓝 |
| C | 证明酸性条件 H2O2氧化性比I2强 | NaI溶液$\stackrel{加入30%H_{2}O_{2}溶液}{→}$$\stackrel{加入稀硝酸及淀粉}{→}$溶液变蓝色 |
| D | 提纯含有少量乙酸的乙酸乙酯 | 试样$\stackrel{加入过量饱和Na_{2}CO_{3}溶液}{→}$$\stackrel{静置分液}{→}$较纯净乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆原理相似 | |
| C. | 雾霾是许多细小液体和固体微粒分散到空气中形成的一种气溶胶 | |
| D. | 光导纤维在信息领域应用越来越广泛,光导纤维的主要成分是Si单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | K | L | ||||||||||||
| M | N | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,F 到 G 的反应类型加成反应或还原反应
,F 到 G 的反应类型加成反应或还原反应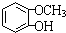 ,姜黄素的结构简式
,姜黄素的结构简式
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com