
| A. | 放电时,正极反应为式:O2+4e-+4H+═2H2O | |
| B. | 放电时,负极反应为式:CH3OH-6e-+8OH-═CO32-+6H2O | |
| C. | 充电时,原电池的负极与电源的正极相连接 | |
| D. | 充电时,阴极反应式为:4OH--4e-═2H2O+O2↑ |
分析 甲醇燃料电池放电时,甲醇所在电极为原电池的负极,发生氧化反应CH3OH-6e-+8OH-═CO32-+6H2O,通入氧气的极为原电池的正极,发生还原反应O2+4e-+2H2O=4OH-,充电时,阴阳极反应与负极正极反应刚好相反,据此分析解答.
解答 解:A、放电时,通入氧气的极为原电池的正极,发生还原反应O2+4e-+2H2O=4OH-,故A错误;
B.放电时,甲醇所在电极为原电池的负极,发生氧化反应CH3OH-6e-+8OH-═CO32-+6H2O,故B正确;
C.充电时,原电池的负极与电源的负极相连接,故C错误;
D.充电时,阴极反应是放电时负极反应的逆反应,CO32-+6e-+6H2O=CH3OH+8OH-,故D错误,
故选B.
点评 本题考查了原电池原理,明确充放电时各个电极上发生的电极反应是解本题关键,难点是电极反应式的书写,要注意结合电解质溶液酸碱性书写,为易错点.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的化学反应叫吸热反应 | |
| B. | 化学反应必然伴随能量变化,没有能量变化的化学反应是不存在的 | |
| C. | 化学反应的能量来自物质状态变化所产生的能量 | |
| D. | 断裂化学键要放热,形成化学键要吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 严格控制硝酸厂的尾气处理 | |
| B. | 倡导使用无磷洗衣粉 | |
| C. | 研究新型催化剂,消除汽车尾气污染 | |
| D. | 禁止使用含氟电冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg $?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg $?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )| A. | 放电时,镁电极为负极,发生氧化反应 | |
| B. | 放电时,正极的电极反应式为Fe3S4+8e-=3Fe+4S2- | |
| C. | 充电时,S2-从阴离子交换膜左侧向右侧迁移 | |
| D. | 充电时转移2mol电子,阴极质量减少32g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
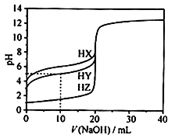 25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )
25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )| A. | HZ是强酸,HX、HY是弱酸 | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-5 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)=c(Z-)+c(Y-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
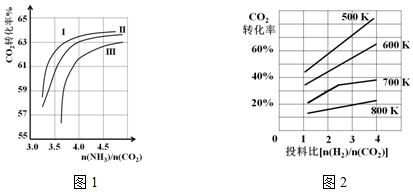
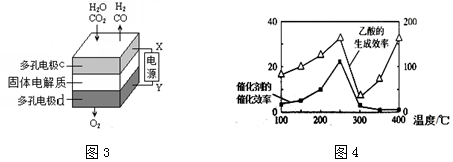
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解Na2SO3溶液,可再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)下列说法正确的是( )
电解Na2SO3溶液,可再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)下列说法正确的是( )| A. | 图中a极要连接电源的负极,C口流出的物质是亚硫酸 | |
| B. | b放电的电极反应式为SO32-+H2O-e-═SO42-+2H+ | |
| C. | 电解过程中若消耗12.6g Na2SO3,则阴极区变化的质量为4.4g(假设该过程中所有液体进出口密闭) | |
| D. | 电子由a经内电路流向b电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com