
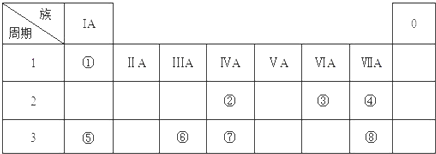
| ||
| 冰晶石 |
| ||
| 冰晶石 |
 ,甲的组成元素的原子结构示意图
,甲的组成元素的原子结构示意图  ,能证明甲的组成元素非金属性很强的事实为氟气和氢气在黑暗处能产生爆炸,
,能证明甲的组成元素非金属性很强的事实为氟气和氢气在黑暗处能产生爆炸, ;
; ;氟气和氢气在黑暗处能产生爆炸.
;氟气和氢气在黑暗处能产生爆炸.


科目:高中化学 来源: 题型:
| A、加入稀硝酸的溶液:K+、Cl-、HS-、SO32- |
| B、加入FeCl3溶液:I-、NH4+、Cl、Ba2+ |
| C、加入NaOH的溶液:Na+、AlO2-、CO32-、K+ |
| D、无色pH=12的溶液:Fe3+、Mg2+、Al3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
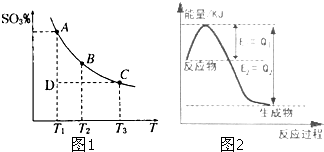 运用化学反应原理研究元素及其化合物的反应有重要意义.
运用化学反应原理研究元素及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+ Mg2+ Fe2+ Al3+ Fe3+ |
| 阴离子 | OH- Cl- CO32- NO3- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3+ |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
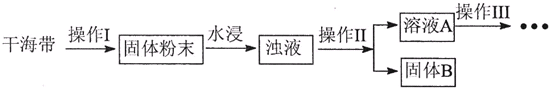
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉溶液后再用硫酸酸化,分装于试管Ⅰ、Ⅱ | 无现象 | |
| ② | 往试管Ⅰ中加入 | 无现象 | 灼烧后碘元素不是以IO3-形式存在 |
| ③ | 往试管Ⅱ中加入 | 灼烧后碘元素以I-形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
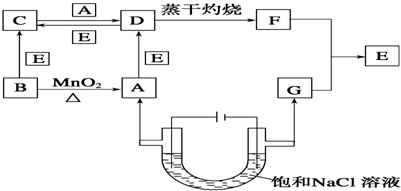
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 所用试剂 | |
| 实验操作及现象 | |
| 有关反应的化学方程式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com