

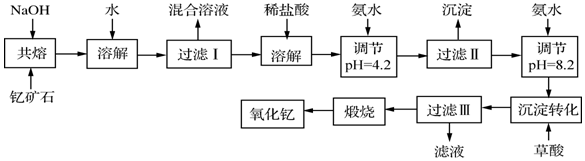
分析 钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O;然后向钛铁矿石中加入过量80%硫酸并加热至343K-353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4,加入X并调节溶液的pH得到沉淀和TiO2+、SO42-,说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,然后将TiO2+、SO42-加热、过滤得到TiO2.2H2O,焙烧得到TiO2.
(1)根据其价电子数及能层数确定在元素周期表中的位置,Ti元素核外有22个电子,根据构造原理书写其基态原子核外电子排布式;氧化亚铁和硫酸反应生成硫酸亚铁,不需要除去杂质FeO;
(2)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水;
(3)④X应该具有强氧化性,且不能引进杂质;
(4)④⑤两步的目的是除去亚铁离子;
(5)⑥中TiO2+水解生成TiO2•2H2O;
(6)阴极上得电子反应还原反应生成金属钛;
(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳;用△H-T△S来判断反应能否发生.
解答 解:(1)Ti元素核外有22个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p63S23p63d24s2(或[Ar]3d24s2),该元素的能层数为4、价电子数为4,所以钛元素位于第四周期第IVB族,氧化亚铁和硫酸反应生成硫酸亚铁,所以净化钛矿石时,不需要除去杂质FeO,
故答案为:第四周期IVB族;不需要;
(2)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水,离子反应方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)④X应该具有强氧化性,且不能引进杂质,具有氧化性的是双氧水和高锰酸钾溶液,但高锰酸钾溶液氧化亚铁离子时引进新的杂质,所以故选A;
故答案为:A;
(4)④⑤两步的目的是除去亚铁离子,防止制得的二氧化钛中含有杂质,
故答案为:除去亚铁离子;
(5)⑥中TiO2+水解生成TiO2.2H2O,反应方程式为TiOSO4+3H2O=TiO2•2H2O↓+H2SO4,
故答案为:TiOSO4+3H2O=TiO2•2H2O↓+H2SO4;
(6)阴极上得电子反应还原反应生成金属钛,电极反应式为TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti),
故答案为:TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti);
(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳,所以需要定期补充碳,TiO2(s)+2Cl2(g)?TiCl4(1)+O2(g)△H=+151kJ/mol该反应中,反应物有2mol气体,生成物只有1mol气体,△S<0,又△H>0,则△H-T△S>0,故反应不能自发进行,
故答案为:碳单质会与阳极产生的氧气反应而不断减少;该反应的△H>0,△S<0,反应难自发进行.
点评 本题考查物质的分离提纯和制备,为高频考点,侧重考查学生对化学工艺流程的理解、分析、判断及对知识的综合运用能力,涉及除杂、氧化还原反应、电解原理、反应的方向判断等知识点,明确化学反应原理、元素化合物性质是解本题关键,易错点是(6)题电极反应式的书写,题目难度中等.


 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素从化合态变为游离态,该元素一定被还原 | |
| B. | 铝合金比纯铝的熔点更高 | |
| C. | 保存FeCl3溶液时,通常在溶液中加少量的单质铁 | |
| D. | 漂白粉应隔绝空气密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纯水100℃和25℃的pH值 | |
| B. | 氢硫酸溶液中的H+和HS-的浓度 | |
| C. | 100mL0.1mol/L的CH3COOH溶液与10mL1.0mol/L的CH3COOH溶液中H+数目 | |
| D. | 25℃,pH=11的KOH溶液与pH=3的CH3COOH溶液中由水电离出的OH-离子浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 •H2O | B. | Na2CO3 •2H2O | C. | Na2CO3 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,加少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| D. | 取样,滴加AgNO3溶液,看是否有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中先滴加氯水,再滴加KSCN溶滚,溶液显血红色,说明原溶液中含有Fe3+ | |
| B. | 向某溶液中滴加过量氨水,先有白色沉淀产生,然后沉淀溶解,说明原溶液中含有Al3+ | |
| C. | 向某溶液中滴加Ca(OH)2溶液,得到白色沉淀,说明原溶液中含有CO32- | |
| D. | 向某溶液中滴加过量NaOH溶液,得到蓝色沉淀,说明原溶液中含有Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 | |
| 腐蚀快慢 | 较快 | 慢 | 较快 | |||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | ||||
| A. | 随pH的升高,碳钢腐蚀速率逐渐加快 | |
| B. | pH<4,发生析氢腐蚀 | |
| C. | pH为14,其负极反应为2H2O+Fe_3e-═FeO2-+4H+ | |
| D. | pH为7时,负极反应为Fe_3e-═Fe3+,生成的Fe3+被空气中的氧气氧化为Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com