
【题目】利用如图所示装置测定中和热的实验步骤如下: 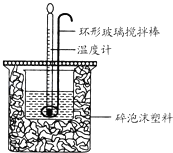
①用量筒量取50mL 0.50molL﹣1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL 0.55molL﹣1 NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?
(2)倒入NaOH溶液的正确操作是(填序号).
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1molL﹣1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3 , 则△H1、△H2、△H3的大小关系为 .
(5)(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 .
【答案】
(1)确保盐酸被完全中和
(2)C
(3)D
(4)△H1=△H2<△H3
(5)不能;因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热
【解析】解:(1)实验中,所用NaOH稍过量的原因是确保定量的盐酸反应完全,
所以答案是:确保盐酸被完全中和;(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,所以答案是:C;(3)使盐酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;所以答案是:D;(4)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和1L 1molL﹣1的稀盐酸恰好完全反应放热57.3kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和1L 1molL﹣1的稀盐酸恰好完全反应放热小于57.3kJ,反应焓变是负值,所以△H1=△H2<△H3;所以答案是:△H1=△H2<△H3;(5)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热.所以答案是:不能;因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知某水泥样品的主要成分为成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。现一实验小组利用实验室中的几种药品对该水泥样品进行检测,以确定其中各金属元素的含量
(1)取水泥样品10.0g,加入足量稀盐酸、氯化铵,使之完全溶解。待充分反应后发现仍有不溶物。将沉淀过滤后加热、干燥,所得固体为________(填化学式)
(2)在分析水泥样品溶解过滤后的滤液成分时,实验小组的同学认为其中含有Ca2+、Al3+、Mg2+、Fe2+、Fe3+等阳离子,现欲准确测量各成分含量,需先加入试剂X将Fe2+转化为Fe3+,待滤液中的Fe2+全部转化为Fe3+后,再向其中加入足量的溶液Y并加热,可使滤液中的Al3+、Mg2+、Fe3+全部形成沉淀,则溶液Y名称是________,而试剂X可选用下列物质中的__________(填选项)
a. HNO3 b. H2O2 c. KMnO4 d. Zn
(3)若将溶液Y改为氢氧化钠溶液,发现所得沉淀共1.008g,比原来减少了0.39g,而这些沉淀能恰好完全溶解于1mol/L,32mL的稀盐酸中,则上述说法中所涉及的水泥样品中金属元素种类及其分别占水泥样品的质量分数为____________、_____________、______________
(4)若最初的水泥样品改为用氢氧化钠溶液溶解,则可能发生的离子反应方程式是:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如图实验装置回答问题. 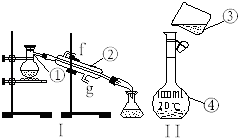
(1)写出下列仪器的名称:①;④;
(2)仪器①~④中,使用时必须检查是否漏水的是 . (填序号)
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有 , 将仪器补充完整后进行的实验操作的名称为;
(4)现需配制250mL、0.2mol/LNaCl溶液,装置II是某同学转移溶液的示意图,图中的错误之处: ① ;②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,所用仪器合理的是( )
A.用25mL的碱式滴定管量取14.80mLNaOH溶液
B.用100mL量筒量取5.2mL的盐酸
C.用托盘天平称取25.20gNaCl
D.用100mL容量瓶配制50mL1.0mol/L盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Fe ![]() FeCl2
FeCl2 ![]() Fe(OH)2
Fe(OH)2
B.S ![]() SO3
SO3 ![]() H2SO4
H2SO4
C.CaCO3 ![]() CaO
CaO ![]() CaSiO3
CaSiO3
D.NH3 ![]() NO
NO ![]() HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A.甲烷的标准燃烧热为890.3 kJ?mol﹣1 , 则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ?mol﹣1
B.已知:H2(g)+ ![]() O2(g)=H2O(g)△H=﹣Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)△H=﹣2Q1kJ/mol
O2(g)=H2O(g)△H=﹣Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)△H=﹣2Q1kJ/mol
C.已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,其热化学方程式为
N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.6 kJ?mol﹣1
D.已知:强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH﹣(aq)?H2O(l)
△H=﹣57.3kJ/mol,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)△H=﹣114.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铜屑和浓硝酸为原料制取硝酸铜,在实际生产中,需把浓硝酸用水稀释.
(1)写出Cu与稀硝酸反应的离子方程式: .
(2)等质量的铜分别与足量浓硝酸、稀硝酸完全反应时,还原产物物质的量之比 .
(3)铜和某浓度的硝酸反应,生成等体积的NO和NO2气体,写出反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 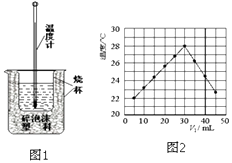
(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和 . 泡沫塑料的作用是 .
(2)若NaOH溶液用相同浓度和体积的下列溶液代替,则对中和热数值测定结果将如何影响(填“偏大”、“偏小”、“无影响”):KOH溶液;氨水(NH3H2O) .
(3)某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由题干及图形可知,V1:V2=时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com