
完成下列问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?_____________。其理由是_____________。
(2)步骤③中加盐酸使溶液呈现强酸性的目的为_____________________。
(3)步骤⑦“合格”的标准是___________________________________。
(4)实验测得样品中无水亚硫酸钠的质量分数是_______________。(列出算式,不需化简)
(1)不能 在酸性条件下,![]() 能将
能将![]() 氧化为
氧化为![]() ,造成实验误差
,造成实验误差
(2)保证得到的沉淀都是BaSO4,没有BaSO3
(3)连续两次称量的质量不变
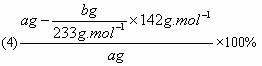
解析:长期存放的亚硫酸钠可能会被部分氧化生成硫酸钠,也就是说该样品中可能含亚硫酸钠和硫酸钠。在所得溶液中加入稀盐酸使溶液呈强酸性是为了除去其中的亚硫酸钠,防止生成亚硫酸钡沉淀,以保证所得沉淀全为硫酸钡。重复⑤⑥两步骤直至恒重,这是定量实验的常用手段。本实验中的BaCl2若用Ba(NO3)2来代替,由于在酸性条件下,![]() 能将
能将![]() 氧化为
氧化为![]() ,造成实验误差。由题意不难得出:b g固体为硫酸钡。由Na2SO4~BaSO4可知,a g样品中的Na2SO4的质量为
,造成实验误差。由题意不难得出:b g固体为硫酸钡。由Na2SO4~BaSO4可知,a g样品中的Na2SO4的质量为![]() ×
×


科目:高中化学 来源: 题型:阅读理解
 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:| 126b |
| 233a |
| 126b |
| 233a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com