
分析 (1)酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大,其抑制水电离程度越大;含有弱离子的盐促进水电离;
(2)加水稀释相同的倍数时,强电解质完全电离,稀释时促进弱电解质电离;
(3)将①④混合,若有c(CH3COO-)>c(H+),混合溶液可能呈酸性、碱性或中性.
解答 解:①0.01mol/L CH3COOH溶液,醋酸部分电离,所以醋酸的pH>2;
②0.01mol/L HCl溶液,HCl完全电离,所以该酸的pH=2;
③pH=12的氨水;
④pH=12的NaOH溶液,一水合氨是弱电解质、NaOH是强电解质,所以c(NaOH)<c(氨水);
⑤0.01mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液,氨水有剩余,且一水合氨电离程度大于铵根离子水解程度,溶液呈碱性;
⑥0.01mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液,二者恰好完全反应生成强酸强碱盐,溶液呈中性;
(1)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子或碱中氢氧根离子浓度越大,其抑制水电离程度越大,①②③④抑制水电离,⑥不影响水电离,其中水的电离程度最大的是⑥,②中氢离子浓度等于③④中氢氧根离子浓度,其抑制水电离程度相同,所以水的电离程度相同的是②③④,
故答案为:⑥;②③④;
(2)将六份溶液同等稀释10倍后,①中电离程度小于②,所以溶液的pH①>②;
加水稀释促进一水合氨电离,稀释相同倍数时③中氢氧根离子浓度大于④,所以pH③>④;
⑤溶液呈碱性、⑥溶液呈中性,所以⑤>⑥,
故答案为:>;>;>;
(3)将①④混合,若有c(CH3COO-)>c(H+),如果溶液中溶质是等物质的量浓度的醋酸和醋酸钠,醋酸电离程度大于醋酸根离子水解程度,存在c(CH3COO-)>c(H+),溶液呈酸性;
如果溶液中溶质为醋酸钠,醋酸水解程度很小溶液中存在c(CH3COO-)>c(H+),溶液呈碱性;
如果溶液中溶质为醋酸钠和少量醋酸,且醋酸电离程度等于醋酸根离子水解程度,溶液中存在c(CH3COO-)>c(H+),溶液呈中性,
故答案为:ABC.
点评 本题考查弱电解质电离及酸碱混合溶液定性判断等知识点,为高频考点,侧重考查学生分析判断能力,明确相同浓度的醋酸和盐酸、相同pH的醋酸和盐酸关系是解本题关键,注意⑤抑制水电离而不是促进水电离,为易错点.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,反应过程中得到6.72L的气体 | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(Na+)=1.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
| 1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
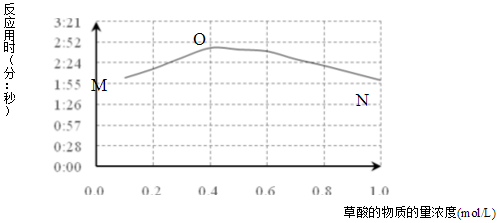
| a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II).(括号中罗马数字表示锰的化合价) |
| b | 草酸根易与不同价态锰离子形成较稳定的配位化合物. |
| c | 草酸稳定性较差,加热至185℃可分解. |
| H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
| 1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
| 1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
| 1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
| 1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
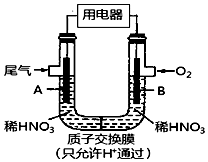 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )| A. | 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路 | |
| B. | 电极B附近的HNO3浓度增大 | |
| C. | A电极的反应为:NO2-e-+H2O═NO3-+2H+,NO-3e-+2H2O═NO3-+4H+ | |
| D. | 该电池工作时,每消耗11.2L O2(标准状况下),可以除去含1mol NO和NO2的混合尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是中学化学中常见的有机物转化关系,A可以提供生命活动所需要的能量,D是石油裂解气的主要成分,E可以发生银镜反应,F的相对分子质量为60,且分子中碳元素的质量分数为40%,下列说法错误的是 ( )
如图是中学化学中常见的有机物转化关系,A可以提供生命活动所需要的能量,D是石油裂解气的主要成分,E可以发生银镜反应,F的相对分子质量为60,且分子中碳元素的质量分数为40%,下列说法错误的是 ( )| A. | 写出DE的化学方程式:2CH2=CH2+O2$\stackrel{催化剂}{→}$2CH3CHO | |
| B. | 写出A 的分子式C6H12O6 | |
| C. | ①的反应类型为水解反应 | |
| D. | 与B含有相同官能团的同分异构体有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 由巨大戟醇制备Picato药物的反应是酯化反应 | |
| B. | 由巨大戟醇制备Picato药物的另一种反应物是CH3C═CHCOOH | |
| C. | 0.1 mol巨大戟醇完全燃烧消耗2.45 molO2 | |
| D. | 巨大戟醇能发生取代反应、氧化反应、加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com