
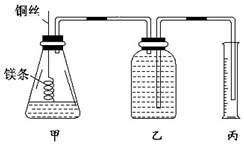
 某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:分析 (1)用实验室中浓盐酸配制100 mL 1.0 mol•L-1的盐酸溶液,需要计算、量取、溶解、转移、洗涤转移、定容等步骤,据此选择仪器,
A.用量筒量取浓盐酸时,俯视量筒的刻度会使所量取溶液的体积减小;
B.向容量瓶中转移时,有少量液体溅出,溶质损失;
C.定容时仰视刻度线,水加入超过刻度线,溶液浓度减小;
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线不会对所配置的溶液的浓度有影响;
(2)步骤③假设a全部是镁结合化学方程式计算得到;Mg+2HCl═MgCl2+H2↑产生的氢气的体积即为排出的水的体积,据此选择量筒的规格;
(3)忽略水蒸气影响,在该实验条件下测得气体摩尔体积的计算式为Vm=$\frac{V}{n}$;若未除去镁条表面的氧化膜,导致生成的氢气体积减少,则测量结果偏小.
解答 解:(1)用实验室中浓盐酸配制100 mL 1.0 mol•L-1的盐酸溶液,需要计算、量取、溶解、转移、洗涤转移、定容等步骤,据此选择仪器,除量筒、烧杯外还需要的玻璃仪器有100mL容量瓶、胶头滴管、玻璃棒,
A.用量筒量取浓盐酸时,仰视量筒的刻度会使所量取溶液的体积增大,使所配置的溶液的浓度偏大,故A符合;
B.向容量瓶中转移时,有少量液体溅出,浓盐酸损耗,配置溶液中溶质减少,配置浓度偏小,故B不符合;
C.定容时仰视刻度线,水加入超过刻度线,溶液浓度减小,故C不符合;
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线不会对所配置的溶液的浓度有影响,故D不符合;
故答案为:100mL容量瓶、胶头滴管、玻璃棒; A;
(2)量10mL 1.0mol•L的盐酸溶液加入锥形瓶中,
Mg+2HCl═MgCl2+H2↑
1mol 2mol
n 0.01mol
n=0.005mol
故a=24g/mol×0.005mol=0.12g,
实验步骤⑤中
Mg+2HCl═MgCl2+H2↑
2mol 1mol
0.01 mol n(H2)
n(H2)=0.005mol
V(H2)=0.005 mol×22.4L/mol=0.112L=112ml,应选200mL量筒;
故答案为:0.12g; B;
(3)0.01mol氯化氢完全反应能够生成0.005mol氢气,该氢气的体积为VmL,若忽略水蒸气的影响,则在该实验条件下测得气体摩尔体积的计算式为:Vm=$\frac{V}{n}$=0.2V L•mol-1;
若未除去镁条表面的氧化膜,导致生成的氢气体积减少,则测量结果偏小,
故答案为:$\frac{V}{5}$mol/L;偏小.
点评 本题主要考查常温下气体摩尔体积的测定,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意掌握气体摩尔体积的概念及计算方法,试题培养了学生的分析、理解能力及化学实验能力.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素的简单气态氢化物的热稳定性X<W | |
| B. | 元素的最高价氧化物对应水化物的酸性:W<Z | |
| C. | 化合物YX、ZX2、WX3中化学键类型相同 | |
| D. | 原子半径的大小顺序:Y>Z>W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| B. | 石油裂解、煤的气化、葡萄糖制取酒精等过程中都包含化学变化 | |
| C. | 低碳经济就是以低能耗、低污染、低排放为基础的经济发展模式 | |
| D. | 食用植物油、麦芽糖和石油气都是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
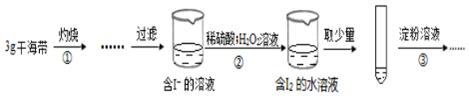
| A. | 步骤①需要将干海带放入坩埚中灼烧 | |
| B. | 步骤②反应的离子方程式为:2I-+2H++H2O2=I2+2H2O | |
| C. | 步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素 | |
| D. | 若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液颜色无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | CH3OH的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应吸热 | |
| B. | 达到平衡时,容器II中c(CH3OH)小于容器I中c(CH3OH)的两倍 | |
| C. | 达到平衡时,容器II中c(H2)大于容器III中c(H2)的两倍 | |
| D. | 达到平衡时,容器III中的正反应速率比容器I中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 正丁烷的二氯代物有6种 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 乙烯使酸性高锰酸钾溶液褪色与乙烯使酸性重铬酸钾变色原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L已烷含有的共价键总数为19NA | |
| B. | 1mol Cu与足量FeCl3溶液反应,转移的电子数为2NA | |
| C. | 1L 0.1mol•-1 Na2CO3溶液中CO32-和HCO3-离子数之和为0.1NA | |
| D. | 密闭容器中1.5molH2与0.5molN2充分反应,得到NH3的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com