
I£®ĻĀĮŠĪļÖŹÖŠŹōÓŚĒæµē½āÖŹµÄŹĒ £»ŹōÓŚČõµē½āÖŹµÄŹĒ £»ŹōÓŚ·Ēµē½āÖŹµÄŹĒ £®£ØĢīŠņŗÅ£© ¢Ł°±Ęų ¢Ś°±Ė® ¢ŪŃĪĖį ¢Ü“×Ėį ¢ŻĮņĖį±µ ¢ŽŅų ¢ßĀČ»ÆÄĘ ¢ą¶žŃõ»ÆĢ¼ ¢į“×Ėįļ§ ¢āĒāĘų
II£®Ä³·“Ó¦ĢåĻµÖŠµÄĪļÖŹÓŠ£ŗCr2£ØSO4£©3”¢K2S2O8”¢K2Cr2O7”¢K2SO4”¢H2SO4”¢H2O£®ŅŃÖŖK2S2O8µÄŃõ»ÆŠŌ±ČK2Cr2O7Ē森
£Ø1£©Ēė½«ŅŌÉĻ·“Ó¦ĪļÓėÉś³ÉĪļ±ąŠ“³ÉŅ»øöŃõ»Æ»¹Ō·“Ó¦·½³ĢŹ½£Ø²»ŅŖĒóÅäĘ½£©
£Ø2£©·“Ó¦ÖŠ£¬±»»¹ŌµÄĪļÖŹŹĒ ŹĒ
£Ø3£©ŌŚĖįŠŌĢõ¼žĻĀK2Cr2O7Óė²ŻĖį£ØH2C2O4£©·“Ó¦µÄ²śĪļŹĒ£ŗCr2£ØSO4£©3”¢CO2”¢K2SO4ŗĶH2O£¬Ōņ»¹Ō¼ĮÓėŃõ»Æ¼ĮĪļÖŹµÄĮæÖ®±ČĪŖ £®
æ¼µć£ŗ Ēæµē½āÖŹŗĶČõµē½āÖŹµÄøÅÄī£»Ńõ»Æ»¹Ō·“Ó¦£»µē½āÖŹÓė·Ēµē½āÖŹ£®
×ØĢā£ŗ Ńõ»Æ»¹Ō·“Ó¦×ØĢā£»µēĄėĘ½ŗāÓėČÜŅŗµÄpH×ØĢā£®
·ÖĪö£ŗ I£®ŌŚĖ®ČÜŅŗĄļ»ņČŪȌדĢ¬ĻĀÄܵ¼µēµÄ»ÆŗĻĪļŹĒµē½āÖŹ£»
ŌŚĖ®ČÜŅŗĄļŗĶČŪȌדĢ¬ĻĀ¶¼²»µ¼µēµÄ»ÆŗĻĪļŹĒ·Ēµē½āÖŹ£»
ĶźČ«µēĄėµÄµē½āÖŹŹĒĒæµē½āÖŹ£¬²æ·ÖµēĄėµÄµē½āÖŹŹĒČõµē½āÖŹ£»
II£®£Ø1£©·ÖĪöø÷ÖÖĪļÖŹĖłŗ¬ŌŖĖŲµÄ»ÆŗĻ¼Ū±ä»Æ½įŗĻK2S2O8µÄŃõ»ÆŠŌ±ČK2Cr2O7ĒæŅĄ¾ŻŃõ»Æ»¹Ō·“Ó¦µÄ¹ęĀÉĶĘÖŖ·“Ó¦ĪļŗĶÉś³ÉĪļ£¬Š“³ö·½³ĢŹ½£»
£Ø2£©ŅĄ¾ŻĪļÖŹĖłŗ¬ŌŖĖŲ»ÆŗĻ¼ŪµÄ±ä»ÆÅŠ¶Ļ±»»¹ŌµÄĪļÖŹ£¬±»Ńõ»ÆµÄĪļÖŹ£»
£Ø3£©ŅĄ¾ŻĪļÖŹĖłŗ¬ŌŖĖŲµÄ»ÆŗĻ¼Ū±ä»ÆÅŠ¶ĻŃõ»Æ¼ĮŗĶ»¹Ō¼Į£¬ŅĄ¾ŻŃõ»Æ¼ĮµĆµ½µÄµē×Ó×ÜŹż=»¹Ō¼ĮŹ§Č„µÄµē×Ó×ÜŹż¼ĘĖć½ā“š£®
½ā“š£ŗ ½ā£ŗI£®¢Ł°±Ęų±¾Éķ²»ÄܵēĄė²śÉś×ŌÓÉĄė×Ó£¬ŹōÓŚ·Ēµē½āÖŹ£»
¢Ś°±Ė®ŹĒ»ģŗĻĪļ£¬¼Č²»ŹĒµē½āÖŹŅ²²»ŹĒ·Ēµē½āÖŹ£»
¢ŪŃĪĖįŹĒ»ģŗĻĪļ£¬¼Č²»ŹĒµē½āÖŹŅ²²»ŹĒ·Ēµē½āÖŹ£»
¢Ü“×ĖįŌŚĖ®ČÜŅŗĄļÄܵ¼µēµÄ»ÆŗĻĪļ£¬ŹĒµē½āÖŹ£»“×ĖįŌŚĖ®ČÜŅŗÖŠ£¬Ö»Äܲæ·ÖµēĄė£¬ŹōÓŚČõµē½āÖŹ£»
¢ŻĮņĖį±µŌŚČŪȌדĢ¬ĻĀÄÜĶźČ«µēĄė³É×ŌÓÉŅĘ¶ÆµÄĄė×Ó¶ųµ¼µēŹĒµē½āÖŹ£¬²¢ĒŅŹĒĒæµē½āÖŹ£»
¢ŽŅųŹĒµ„ÖŹ£¬¼Č²»ŹĒµē½āÖŹŅ²²»ŹĒ·Ēµē½āÖŹ£»
¢ßĀČ»ÆÄĘŌŚĖ®ČÜŅŗ»ņÕßČŪȌדĢ¬ĻĀÄÜĶźČ«µēĄė³É×ŌÓÉŅĘ¶ÆµÄĄė×Ó¶ųµ¼µēŹĒµē½āÖŹ£¬²¢ĒŅŹĒĒæµē½āÖŹ£»
¢ą¶žŃõ»ÆĢ¼±¾Éķ²»ÄܵēĄė²śÉś×ŌÓÉĄė×Ó£¬ŹōÓŚ·Ēµē½āÖŹ£»
¢į“×Ėįļ§ŌŚĖ®ČÜŅŗ»ņÕßČŪȌדĢ¬ĻĀÄÜĶźČ«µēĄė³É×ŌÓÉŅĘ¶ÆµÄĄė×Ó¶ųµ¼µēŹĒµē½āÖŹ£¬²¢ĒŅŹĒĒæµē½āÖŹ£»
¢āĒāĘųŹōÓŚµ„ÖŹ£¬¼Č²»ŹĒµē½āÖŹŅ²²»ŹĒ·Ēµē½āÖŹ£»
ĖłŅŌŹōÓŚĒæµē½āÖŹµÄŹĒ¢Ż¢ß¢į£»ŹōÓŚČõµē½āÖŹµÄŹĒ¢Ü£»ŹōÓŚ·Ēµē½āÖŹµÄŹĒ¢Ł¢ą£»
¹Ź“š°øĪŖ£ŗ¢Ż¢ß¢į£»¢Ü£»¢Ł¢ą£»
II£®£Ø1£©Cr2£ØSO4£©3”śK2Cr2O7øõŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ»K2S2O8”śK2SO4”¢H2SO4ĮņŌŖĖŲ»ÆŗĻ¼Ū½µµĶ£¬ÓÖŅņĪŖK2S2O8µÄŃõ»ÆŠŌ±ČK2Cr2O7Ē棬ĖłŅŌ·“Ó¦ĪļĪŖ£ŗK2S2O8ŗĶCr2£ØSO4£©3£¬Éś³ÉĪļĪŖK2Cr2O7”¢K2SO4”¢H2SO4£¬ŅĄ¾ŻŌ×ÓøöŹżŹŲŗć£¬æÉÖŖĖ®ĪŖ·“Ó¦Īļ£¬Ōņ·“Ó¦µÄ·½³ĢŹ½ĪŖ£ŗ
K2S2O8+Cr2£ØSO4£©3+H2O”śK2Cr2O7+K2SO4+H2SO4£»
¹Ź“š°øĪŖ£ŗK2S2O8+Cr2£ØSO4£©3+H2O”śK2Cr2O7+K2SO4+H2SO4£»
£Ø2£©K2S2O8+Cr2£ØSO4£©3+H2O”śK2Cr2O7+K2SO4+H2SO4ÖŠK2S2O8ÖŠS»ÆŗĻ¼Ū½µµĶ£¬±»»¹Ō£»Cr2£ØSO4£©3ÖŠCrŌŖĖŲ»ÆŗĻ¼ŪÉżøß±»Ńõ»Æ£¬×ö»¹Ō¼Į£»
¹Ź“š°øĪŖ£ŗK2S2O8£»»¹Ō¼Į£»
£Ø3£©ŌŚĖįŠŌĢõ¼žĻĀK2Cr2O7Óė²ŻĖį£ØH2C2O4£©·“Ó¦£¬øõŌŖĖŲ»ÆŗĻ¼ŪÓÉ+6”ś+3£¬K2Cr2O7×öŃõ»Æ¼Į±»»¹Ō£¬H2C2O4ÖŠµÄĢ¼ŌŖĖŲÓÉ+3”ś+4»ÆŗĻ¼ŪÉżøß±»Ńõ»Æ£¬×ö»¹Ō¼Į£¬Éč»¹Ō¼ĮµÄĪļÖŹµÄĪļÖŹµÄĮæx£¬Ńõ»Æ¼ĮĪļÖŹµÄĮæĪŖy£¬
ŌņŅĄ¾ŻŃõ»Æ»¹Ō·“Ó¦µĆŹ§µē×ÓŹŲŗć¹ęĀÉæÉµĆ£»
x”Į2”Į£Ø4﹣3£©=y”Į2”Į£Ø6﹣3£©
»Æ¼ņµĆ£ŗx£ŗy=3£ŗ1£»
¹Ź“š°øĪŖ£ŗ3£ŗ1£®
µćĘĄ£ŗ ±¾ĢāĪŖ×ŪŗĻĢāæ¼²éĮĖµē½āÖŹ”¢·Ēµē½āÖŹ”¢ĒæČõµē½āÖŹµÄÅŠ¶Ļ”¢Ńõ»Æ»¹Ō·“Ó¦µÄ¹ęĀÉ£¬½āĢā¹Ų¼üŌŚÓŚ×¼Č·ÅŠ¶ĻŌŖĖŲ»ÆŗĻ¼ŪµÄ±ä»Æ£¬°ŃĪÕŃõ»Æ»¹Ō·“Ó¦ÖŠµĆŹ§µē×ÓŹŲŗć¹ęĀÉ£¬ĢāÄæÄѶČÖŠµČ£®


 Š”ѧɜ10·ÖÖÓæŚĖć²āŹŌ100·ÖĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓæŚĖć²āŹŌ100·ÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijČÜŅŗÖŠ“ęŌŚ“óĮæµÄH+”¢NO3©”¢Cl©£¬øĆČÜŅŗÖŠ»¹æÉÄÜ“óĮæ“ęŌŚµÄĄė×ÓŹĒ£Ø””””£©
”” A£® CO32© B£® OH© C£® Ag+ D£® SO42©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½«a mol•L﹣1µÄNa2CO3ČÜŅŗÓėb mol•L﹣1µÄNaHCO3ČÜŅŗµČĢå»ż»ģŗĻ£¬ĖłµĆČÜŅŗÖŠĮ£×ÓÅØ¶Č¼äµÄ¹ŲĻµ¼°Ļą¹ŲÅŠ¶Ļ²»ÕżČ·µÄŹĒ£Ø£©
A£® c£ØNa+£©+c£ØH+£©£¾c£ØCO32﹣£©+c£ØHCO3﹣£©+c£ØOH﹣£©
B£® c£ØNa+£©£¾c£ØCO32﹣£©+c£ØHCO3﹣£©+c£ØH2CO3£©
C£® Čōc£ØNa+£©£¾c£ØHCO3﹣£©£¾c£ØCO32﹣£©£¾c£ØOH﹣£©£¾c£ØH+£©£¬ŌņŅ»¶Øa£¼b
D£® Čōa=b£¬ŌņČÜŅŗÖŠc£ØHCO3﹣£©£¾c£ØCO32﹣£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÄÜÕżČ·±ķŹ¾ĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ£Ø£©
A£® ÅØŃĪĖįÓėĢśŠ¼·“Ó¦£ŗ2Fe+6H+═2Fe3++3H2”ü
B£® ÄĘÓėCuSO4ČÜŅŗ·“Ó¦£ŗ2Na+Cu2+═Cu”ż+2Na+
C£® NaHCO3ČÜŅŗÓėĻ”H2SO4·“Ó¦£ŗCO32﹣+2H+═H2O+CO2”ü
D£® ĻņFeCl3ČÜŅŗÖŠ¼ÓČėMg£ØOH£©2£ŗ3Mg£ØOH£©2+2Fe3+═2Fe£ØOH£©3+3Mg2+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijĪ“ÖŖČÜŅŗæÉÄÜŗ¬Cl﹣”¢CO32﹣”¢Na+”¢SO42﹣”¢Al3+£¬½«ČÜŅŗµĪŌŚĄ¶É«ŹÆČļŹŌÖ½ÉĻ£¬ŹŌÖ½±äŗģ£®Č”ÉŁĮæŹŌŅŗ£¬¼ÓĻõĖįĖį»ÆµÄĀČ»Æ±µČÜŅŗ£¬ÓŠ°×É«³ĮµķÉś³É£»ŌŚÉĻ²ćĒåŅŗÖŠµĪ¼ÓĻõĖįŅųČÜŅŗ£¬²śÉś°×É«³Įµķ£®ĻĀĮŠÅŠ¶ĻŗĻĄķµÄŹĒ£Ø£©
A£® Ņ»¶ØÓŠCl﹣ B£® Ņ»¶ØÓŠSO42﹣ C£® Ņ»¶ØƻӊAl3+ D£® Ņ»¶ØÓŠCO32﹣
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠÉč±ø¹¤×÷Ź±£¬½«»ÆѧÄÜ×Ŗ»ÆĪŖµēÄܵďĒ£Ø£©
A£® A B£® B C£® C D£® D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ×°ÖĆĖłŹ¾µÄŹµŃ飬ÄÜ“ļµ½ŹµŃéÄæµÄŹĒ£Ø£©
A£® 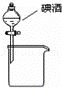
·ÖĄėµā¾ĘÖŠµÄµāŗĶ¾Ę¾« B£® 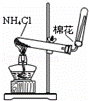
ŹµŃéŹŅÖĘ°±Ęų
C£® 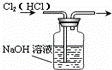
³żČ„Cl2ÖŠµÄHCl D£® 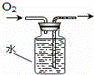
ÅÅĖ®¼ÆĘų·ØŹÕ¼ÆO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĪļÖŹ£ŗ¢ŁO2¢ŚČżĀČ¼×Ķé¢ŪCH3CH2CH2OH¢ÜO3¢ŻCHCl3 CH3OCH2CH3¢ß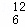 C ¢ąCH3CH£ØOH£©CH3¢į
C ¢ąCH3CH£ØOH£©CH3¢į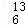 C ¢āCH3OH£®
C ¢āCH3OH£®
ĘäÖŠŹōÓŚĶ¬ĻµĪļµÄÓŠ £ØĢīŠņŗÅ£¬ĻĀĶ¬£©£¬
»„ĪŖĶ¬·ÖŅģ¹¹ĢåµÄÓŠ £¬
»„ĪŖĶ¬ĖŲŅģŠĪĢåµÄÓŠ £¬
ŹōÓŚĶ¬Ī»ĖŲµÄÓŠ £¬
ŹĒĶ¬Ņ»ÖÖĪļÖŹµÄÓŠ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¢Ł2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
¢ŚK2Cr2O7+6FeSO4+7H2SO4=3Fe2£ØSO4£©3+K2SO4+7H2O
¢ŪFe2£ØSO4£©3+2HI=2FeSO4+I2+H2SO4
ĻĀĮŠ½įĀŪÕżČ·µÄŹĒ£Ø£©
A£® ¢Ł¢Ś¢Ū¾łŹĒŃõ»Æ»¹Ō·“Ó¦
B£® Ńõ»ÆŠŌĒæČõĖ³ŠņŹĒK2Cr2O7£¾Fe2£ØSO4£©3£¾I2
C£® ·“Ó¦¢ŚÖŠŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ6£ŗ1
D£® ·“Ó¦¢ŪÖŠ0.1mol»¹Ō¼Į¹²Ź§Č„µē×ÓŹżĪŖ6.02”Į1023
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com