
| A. | 20 mol-2•L-2 | B. | 32 mol-2•L-2 | C. | 25 mol-2•L-2 | D. | 16 mol-2•L-2 |
分析 2min平衡后,测知H2的浓度为2mol•L-1,HBr的浓度为4mol•L-1,则
②2HBr(g)?Br2(g)+H2(g),
转化 4 2
①NH4Br(s)?NH3(g)+HBr(g)
平衡 4+4 4
结合K为生成物浓度幂之积与反应物浓度幂之积的比计算.
解答 解:2min平衡后,测知H2的浓度为2mol•L-1,HBr的浓度为4mol•L-1,则
②2HBr(g)?Br2(g)+H2(g),
转化 4 2
①NH4Br(s)?NH3(g)+HBr(g)
平衡 4+4 4
则在该温度下①平衡常数K=8mol/L×4mol/L=32 mol-2•L-2,
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握平衡浓度及K的关系为解答的关键,侧重分析与计算能力的考查,注意结合平衡浓度计算K,题目难度不大.


科目:高中化学 来源: 题型:选择题
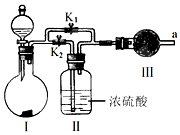
| A.图装置中X为苯,可用于吸收NH3或HCl,并防止倒吸 | B.图装置可用于铜与浓硫酸反应制取并收集二氧化硫 | C.图装置可用于硫酸铜溶液的蒸发浓缩,然后冷却制硫酸铜晶体 | D.记录滴定终点读数为12.20mL |
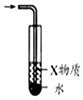 | 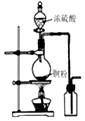 | 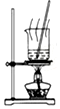 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g铁高温下与足量水蒸气充分反应转移电子数目为3NA | |
| B. | 100 g CaCO3和KHCO3混合固体中CO32-的数目为NA | |
| C. | 实验室用H2O2制备1mol O2转移的电子数为2NA | |
| D. | 标准状况下,2.24L CCl4含有的原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次增强 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C12按体积比1:3混合可制得纯净的CHCl3 | |
| B. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| C. | C3H6O2有3种同分异构体,它们均能与钠反应放出氢气 | |
| D. | 人体内的蛋白质分解,最终生成二氧化碳和水排出体外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
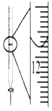
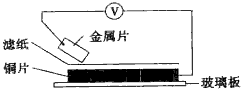 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如表 | 金属 | 电子流动方向 | 电压 |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | +0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | 丁→Cu | +0.30 |
| A. | 在四种金属中乙的还原性最强 | |
| B. | 金属乙能从硫酸铜溶液中置换出铜 | |
| C. | 甲、丁若形成原电池时,甲为负极 | |
| D. | 甲、乙形成合金在空气中,乙先被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com