
| 物质 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | Kal=4.4×10-7 Ka2=4.7×10-11 | 3.0×10-8 |
分析 (1)利用盖斯定律分析,注意氢氟酸是弱电解质;
(2)氢氟酸是弱电解质,溶液中存在电离平衡,加水稀释其溶液促进氢氟酸电离,注意水的离子积常数只与温度有关;
(3)电离吸热,影响弱酸电离平衡移动的因素有温度、各微利浓度.
解答 解:(1)通过表格知,氢氟酸是弱电解质,将方程式①-②得HF(aq)?H+(aq)+F-(aq)△H=-10.4KJ•mol-1,
故答案为:HF(aq)?H+(aq)+F-(aq)△H=-10.4KJ•mol-1;
(2)氢氟酸是弱电解质,溶液中存在电离平衡,加水稀释其溶液促进氢氟酸电离,
A.稀释过程中促进氢氟酸电离,但c(H+)减小,故A错误;
B.温度不变,水的离子积常数不变,所以c(H+)•c(OH-)不变,故B错误;
C.稀释过程中促进氢氟酸电离,氢离子个数增大,氟化氢分子个数减小,所以$\frac{c({H}^{+})}{c(HF)}$ 增大,故C正确;
D.稀释过程中促进氢氟酸电离,氢离子浓度降低,氢氧根离子浓度增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$增大,故D正确;
故答案为:CD;
(3)a、据(1)中的方程式HF(aq)?H+(aq)+F-(aq)△H=-10.4KJ•mol-1可知,HF电离放热,升温其电离程度减小,故a错误;
b、加入盐酸,氢离子浓度增大,电离平衡逆向移动,故b错误;
c、加入NaF,氟离子浓度增大,平衡逆向移动,故c错误;
d、加水稀释,平衡正向移动,0.10mol•L-1 HF溶液中HF电离程度增大,故d正确;
故答案为:d.
点评 本题考查了弱电解质的电离、电离平衡移动及电离方程式书写,为高频考点和常见题型,题目难度不大.


科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
H2S水溶液中存在电离平衡H2S ?H++HS-和HS-
?H++HS-和HS- ?H++S2-。若向H2S溶液
?H++S2-。若向H2S溶液
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
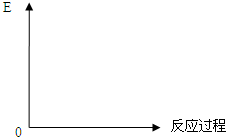 Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应
Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完反应,放出的热量为28.7 kJ | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 | |
| D. | 2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则碳的燃烧热等于 110.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
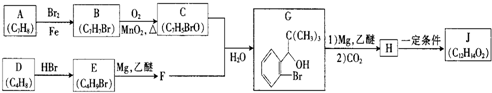
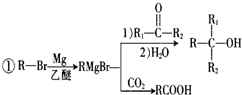
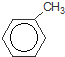 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$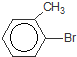 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应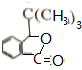
 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
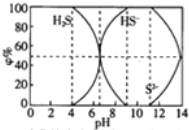
| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/L CuSO4都有CuS沉淀(Kφ(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径C>D>B>A | B. | 原子序数D>C>B>A | ||
| C. | 原子半径A>B>D>C | D. | 单质的还原性A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com