
| A. | 碳酸钠(固体) | B. | 少量硫酸铜溶液 | C. | NaCl溶液 | D. | 加热 |
分析 根据反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,以此来解答.
解答 解:A.碳酸钠与酸反应,生成氢气的量减少,故A错误;
B.锌置换出铜,形成铜锌原电池,反应速率增大,故B错误;
C.加适量的NaCl溶液,相当于稀释,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故C正确;
D.加热溶液温度升高,反应速率增大,故D错误.
故选C.
点评 本题考查影响化学反应速率的因素,明确浓度对反应速率的影响即可解答,选项B为学生解答中的难点,注意原电池反应的特点,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入BaCl2溶液中无明显现象,说明碳酸的酸性比盐酸弱 | |
| B. | 氯水加入稀盐酸和AgNO3溶液产生白色沉淀,说明有氯水中有Cl-存在 | |
| C. | 常温下,Cu片投入到浓硫酸中不反应,因为浓硫酸使Cu产生钝化现象 | |
| D. | 浓硫酸具有脱水性,因而能使胆矾失去结晶水由蓝色变白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验目的 | 实验方法 |
| ① | 检验混合气体N2和NH3中有NH3 | |
| ② | 除去NaCl和NH4Cl固体混合物中的杂质NH4Cl | |
| ③ | 观察铜与浓硫酸在试管中共热后产物溶液的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由二氧化碳和氧气组成的混合气体共有NA个分子,其中氧原子数为2NA | |
| B. | 1mol铜与足量稀硝酸反应可产生NO分子$\frac{2}{3}$NA个. | |
| C. | 12g金刚石中含有共价键数为4NA | |
| D. | 1L1mol/L硫酸铝溶液中阴阳离子总数大于5NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ Na+ HSO3- Cl- | B. | Na+ Ba2+[Al(OH)4]- NO3- | ||
| C. | NH4+ K+ Cl- NO3- | D. | Fe2+ Na+ ClO- S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式: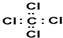 | B. | 氢氧根的电子式: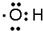 | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 乙醇的结构简式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下80gSO2与33.6LCO2含氧原子数目均为3NA | |
| B. | 2molNO与1molO2混合后气体分子数小于2NA | |
| C. | 电解精炼铜时,阳极上粗铜质量减少6.4g,则电路中转化电子数为0.2NA | |
| D. | 1molCnH2n(烯烃)含有的共用电子对数为3nNA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com