
 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.| a | |||||
| b | |||||
| c | d | e |
 .
.分析 五种短周期元素在元素周期表中的相对位置如表所示,a处于第一周期左边为H元素,b处于第二周期在a的下一周期元素锂的向右5列为氧元素,
c与H处在同一主族,在第三周期为Na元素,则d为Al元素、e为S元素,据此结合元素周期律知识进行判断.
(1)同周期自左而右,元素的金属性减弱,同主族自上而下,金属性增强,c、e两元素形成的离子化合物硫化钠,电子式钠离子用离子符号表示,硫离子需标出最外层电子;
(2)c、d、e三种元素的简单离子分别为钠离子、铝离子、硫离子,微粒半径,层多半径大,同层核大半径小;
(3)b、e两元素分别与a形成的最简单气态化合物分别为水、硫化氢,中心原子非金属性越强,其氢化物越稳定;
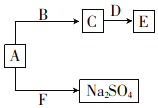
(4)F是引起酸雨的主要气体,则F为SO2,A与F反应生成硫酸钠,A为淡黄色固体,可知A为Na2O2,B是常见液体,D是两性氧化物,结合转化可知,B为水,C为NaOH,D为Al2O3,E为NaAlO2,以此来解答.
解答 解:(1)根据五种短周期元素在元素周期表中的相对位置可知:a为H元素,b为O元素,c为Na元素,d为Al元素、e为S元素,五种元素金属为Na元素、Al元素,Na、Al属于同一周期,原子序数依次增大,同周期自左而右,元素的金属性减弱,故金属性Na>Al,硫化钠为离子化合物,钠离子直接用离子符号表示,硫离子需要标出所带电荷及最外层电子,硫化钠的电子式为 ,
,
故答案为:Na; ;
;
(2)Na+、Al3+具有相同电子层结构,电子层数相同,随着核电荷数的增加,原子核对核外电子的吸引能力增强,离子半径减小,故离子半径:Na+>Al3+,电子层越多离子半径越大,S2-比Na+、Al3+多一层电子,所以三者半径大小为S2->Na+>Al3+,
故答案为:Al3+;
(3)O、S属于同一主族,同一主族从上向下非金属性减弱,O的非金属性比S强,所以稳定性:H2O>H2S(或H2S<H2O),
故答案为:H2O>H2S(或H2S<H2O);
(4)①F是引起酸雨的主要气体,则F为SO2,A与F反应生成硫酸钠,A为淡黄色固体,可知A为Na2O2,B是常见液体,D是两性氧化物,结合转化可知,B为水,C为NaOH,D为Al2O3,E为NaAlO2,
故答案为:NaAlO2;
②A为Na2O2,F为SO2,A与F反应生成硫酸钠,反应的化学方程式为Na2O2+SO2=Na2SO4,
故答案为:Na2O2+SO2=Na2SO4.
点评 本题考查原子结构与元素周期律的应用、无机物的推断,为高频考点,注意掌握原子结构与元素周期律、元素周期表的关系,把握酸雨、淡黄色固体为推断的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,试题培养了学生的灵活应用能力,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B的物质的量浓度 | D. | 混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 项目 | 空气污染指数(API) | 空气质量级别 | 空气质量描述 |
| 总悬浮颗粒 | 52 | Ⅱ | 良 |
| 二氧化硫 | 7 | I | 优 |
| 二氧化氮 | 24 | I | 优 |
| A. | 用煤和石油产品作燃料 | B. | 汽车排放的尾气 | ||
| C. | 使用含磷洗衣粉 | D. | 焚烧垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中所有原子均满足8电子稳定结构 | |
| D. | SiF4和SO32-的中心原子均为印sp3杂化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com