
| A. | Fe位于元素周期表第四周期,VⅢA族 | |
| B. | K在同周期中,原子半径最大,金属性最强 | |
| C. | .高铁酸钾具有强氧化性 | |
| D. | 高铁酸钾中Fe的化合价为+6 |
分析 A.Fe的原子序数为26,为ⅤⅢ族元素;
B.同周期从左向右原子半径减小、金属性减弱;
C.Fe元素的化合价为+6价,易得到电子;
D.K为+1价,O为-2价,化合物中正负化合价的代数和为0.
解答 解:A.Fe的原子序数为26,位于元素周期表第四周期、ⅤⅢ族,为过渡金属元素,故A错误;
B.同周期从左向右原子半径减小、金属性减弱,则K在同周期中,原子半径最大,金属性最强,故B正确;
C.Fe元素的化合价为+6价,易得到电子,则高铁酸钾具有强氧化性,故C正确;
D.K为+1价,O为-2价,化合物中正负化合价的代数和为0,则Fe元素的化合价为+6价,故D正确;
故选A.
点评 本题考查物质中元素的性质,为高频考点,把握元素的位置、元素的性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去乙酸乙酯中混有的乙酸,可以用饱和碳酸钠溶液 | |
| B. | 顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 | |
| C. | 聚合物 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 | |
| D. | C3H2Cl6有4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,溶液的pH会增大 | |
| B. | 加入少量固体NaOH,溶液中c(CH3COO-)+c(OH-)>c(Na+)+c(H+) | |
| C. | 加入少量0.1mol•L-1的硫酸,水电离产生的c(H+)减小 | |
| D. | 与0.1mol•L-1的NaOH溶液等体积混合后,溶液中c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜、不锈钢都是合金 | |
| B. | 铜在空气中会生成铜诱 | |
| C. | 多数合金的熔点高于组成它的成分金属的熔点 | |
| D. | 铝是活泼金属,但在空气中耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
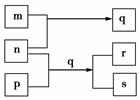 元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,m是生产、生活中运用最广泛的金属单质,n通常为深红棕色液体,r是一种强酸,p是来自于煤的一种常见有机物,s是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法正确的是( )
元素W、X、Y、Z的原子序数依次增加.p、q、r是由这些元素组成的二元化合物.m、n分别是元素Y、Z的单质,m是生产、生活中运用最广泛的金属单质,n通常为深红棕色液体,r是一种强酸,p是来自于煤的一种常见有机物,s是难溶于水、比水重的油状液体.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 四种元素中存在第三周期元素 | |
| B. | W的氧化物常温常压下为液态 | |
| C. | 常温下将m投入浓硫酸中不发生任何反应 | |
| D. | p的最简式是CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH | B. | CH2BrC(CH3)3 | ||
| C. | CH3CH2C(CH3)2OH | D. | CH3CH2C(CH3)2 CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图.b电极是正极.请写出负极的电极反应方程式:(CH3)2O-12e-+3H2O=2CO2+12H+.
如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图.b电极是正极.请写出负极的电极反应方程式:(CH3)2O-12e-+3H2O=2CO2+12H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ | |
| C. | 由C(石墨)→C(金刚石);△H=+73 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-285.8kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com