

 2MnCl2+Cl2↑+4H2O
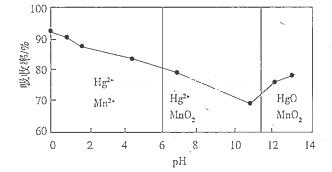
2MnCl2+Cl2↑+4H2O  2MnCl2+Cl2↑+4H2O。(5)铜帽溶解时加入H2O2的目的是为了溶解Cu单质。反应的方程式为Cu+H2O2+H2SO4=CuSO4+2H2O。铜帽溶解完全后,溶液中含有过量的H2O2。由于H2O2不稳定,受热容易发生分解反应产生氧气和水。所以可采用加热的方法除去溶液中过量的H2O2。(6)根据上图可知:①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率逐渐降低,当溶液的pH>11后又增加。即:先降低后升高。②在强酸性环境下Hg的吸收率高的原因可能是强酸性环境中KMnO4的氧化性强。
2MnCl2+Cl2↑+4H2O。(5)铜帽溶解时加入H2O2的目的是为了溶解Cu单质。反应的方程式为Cu+H2O2+H2SO4=CuSO4+2H2O。铜帽溶解完全后,溶液中含有过量的H2O2。由于H2O2不稳定,受热容易发生分解反应产生氧气和水。所以可采用加热的方法除去溶液中过量的H2O2。(6)根据上图可知:①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率逐渐降低,当溶液的pH>11后又增加。即:先降低后升高。②在强酸性环境下Hg的吸收率高的原因可能是强酸性环境中KMnO4的氧化性强。

科目:高中化学 来源:不详 题型:填空题
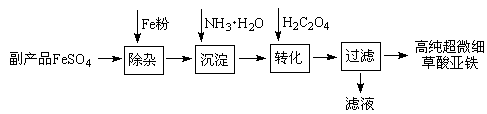
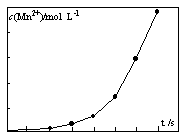
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
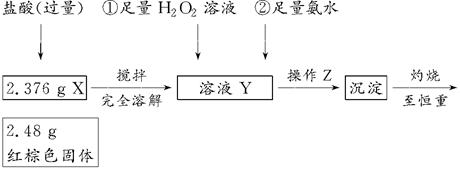

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
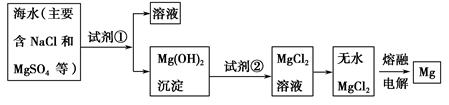
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题



| | 苯 | 溴 | 溴苯 |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
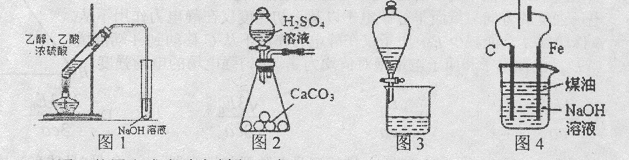
| A.用图l装置完成实验室制取乙酸乙酯 |
| B.用图2所示装置可制取大量的CO2气体 |
| C.用图3所示装置可分离溴的四氯化碳溶液和水 |
| D.用图4装置制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
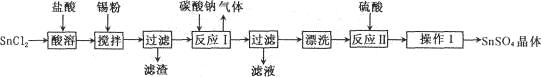
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质及其杂质 | 检验 | 除杂 |
| A.Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B.NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C.CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D.NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com