
【题目】短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为 .
(2)已知:
①E﹣E→2E△H=+a kJmol﹣1;
②2A→A﹣A△H=﹣b kJmol﹣1;
③E+A→A﹣E△H=﹣c kJmol﹣1;
写出298K时,A2与E2反应的热化学方程式 .
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)X(g)△H=﹣a kJmol﹣1(a>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则A2的平均反应速率v(A2)= .
②计算该温度下此反应的平衡常数K= .
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填字母).
A.α1+α2=1
B.Q1+Q2=a
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
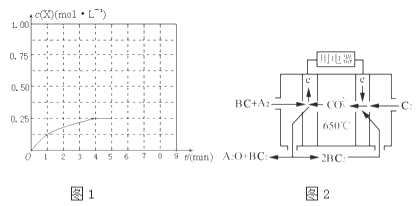
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在图1中画出第5min到新平衡时X的物质的量浓度的变化曲线.
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池.目前已接近商业化,示范电站规模已达2MW,从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出碳酸盐燃料电池(MCFC)正极电极反应式 .
【答案】(1)离子键、极性键(或共价键);
(2)H2(g)+Cl2(g)=2HCl(g)△H=(a+b﹣2c)kJmol﹣1;
(3)①0.125molL﹣1min﹣1;②4 L2/mol2;③ABD;
④
(4)O2+4e﹣+2CO2=2CO32﹣
【解析】
试题分析:短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,则A为H元素;B是形成化合物种类最多的元素,则B为C元素;C原子的最外层电子数是次外层电子数的3倍,C原子只能有2个电子层,最外层电子数为6,故C为O元素;D是同周期中金属性最强的元素,处于ⅠA,结合原子序数可知,D处于第三周期,故D为Na;E的负一价离子与C的某种氢化物分子含有相同的电子数,可推知E为Cl;
(1)A、C、D形成的化合物是NaOH,NaOH中钠离子和氢氧根离子之间存在离子键、H原子核O原子之间存在极性共价键,故答案为:离子键、极性键(或共价键);
(2)①E-E→2E△H=+a kJmol-1;
②2A→A-A△H=-b kJmol-1;
③E+A→A-E△H=-c kJmol-1;
将方程式①+②-2③得H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c)kJmol-1;
(3)①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,生成0.5molX需要n(A2)=2n(X)=1mol,则![]() =0.125molL-1min-1;
=0.125molL-1min-1;
②平衡时c(X)=0.5mol/2L=0.25mol/L,c(A2)=(20.5×2)mol/2L=0.5mol/L,
c(BC)=(10.5)mol/2L=0.25mol/L,则平衡常数K=![]() =4L2/mol2;
=4L2/mol2;
③甲容器反应物投入2molH2、1molCO与乙容器反应物投入2mol CH3OH在保持恒温、恒容情况下是等效平衡,平衡时CH3OH的物质的量n2=0.5mol、p1=p2、α1+α2=1、Q1+Q2能量总变化相当于2molH2、1molCO完全转化成2mol CH3OH的能量,即吸放热Q1+Q2数值上就等于akJ;甲容器反应物投入量2molH2、1molCO与丙容器反应物投入量4molH2、2molCO,若恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡,然而现在是温度、容积相同的3个密闭容器,我们可以当成是在恒温且容积是甲容器两倍条件下,体积受到了压缩,原反应正向气体体积减少,由平衡移动原理,则相较于甲容器(或假设状况)而言,丙容器平衡向逆向移动,也就是说,丙容器的转化率比甲容器还要低一些,因此α1+α2=1、Q1+Q2=a;α3>α1;P3<2P1=2P2、n3<n2<1.0mol、Q3>2Q1,故答案为ABD;
④将甲容器的体系体积压缩到1L,若在第8min 达到新的平衡时,
2H2(g)+CO(g)CH4O(g)
初始量:2 1 0
变化量:1.5 0.75 0.75
平衡量:0.5 0.25 0.75
所以达到平衡时,甲醇的物质的量浓度是0.75mol/L,在第5min时,由于体积减半,所以甲醇的浓度应该加倍,即为0.25mol/L×2=0.5mol/L,所以5-8min内,甲醇的物质的量浓度从0.5mol/L升高到0.75mol/L,如图所示: ;
;
(4)碳酸盐燃料电池正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32。


科目:高中化学 来源: 题型:
【题目】黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
![]()
已知碳的燃烧热△H1=akJ·mol—1
![]()
则x为
A.a+b-c B.c+3a-b C.3a+b-c D.c+a-b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国首个空间实验室——“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氣燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,a、b、c、d均为Pt电极。 下列说法正确的是( )
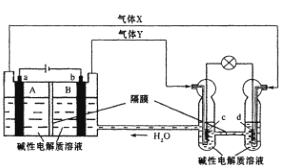
A. B区的OH-通过隔膜向a电极移动,A 区pH增大
B. 图中右管中的OH-通过隔膜向c电极移动,d电极上发生还原反应
C. c是正极,电极上的电极反应为2H++2e-=H2↑
D. 当有lmol电子转移时,b电极产生气体Y的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol A与2 mol B混合于2 L的密闭容器中,发生反应:2A(g)+3B(g)![]() 2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为25%
D.C平衡时的浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系( )
A.乳浊液
B.溶液
C.胶体
D.悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D、C与E分别同主族,D、E、F同周期,B原子的最外层电子数是内层电子数的2.5倍,A与C形成的常见化合物在常温下为液态。
(1)元素A在周期表中的位置是________;D、E、F形成的简单离子中半径最大的是_______(填离子符号)。
(2)常温下,F的单质能与由A、C、D三种元素组成的一种常见化合物发生反应,该反应的化学方程式为________。
(3) E与F的最简单气态氢化物中稳定性较强的是________(填化学式)。
(4)元素B和元素F能形成一种化合物BF3,其中F显+1价。BF3能发生水解反应生成一种弱碱和一种弱酸,写出该反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
酸 | 碱 | 盐 | |
A | H2SO4 | NaOH | BaCO3 |
B | H2S | K2CO3 | CuSO4 |
C | NaHSO4 | NaOH | CaCl2 |
D | HNO3 | KOH | Na2O |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程是化学变化,且属于放热反应的是
①Ba(OH)2·8H2O晶体与氯化铵反应 ②酸碱中和 ③浓硫酸稀释 ④固体NaOH溶于水 ⑤硫在空气或氧气中燃烧
A. ②③④⑤ B. ②③④ C. ②⑤ D. ①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com