
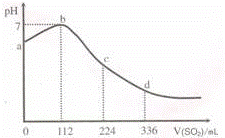
标准状况下,某同学向100mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
|
| A. | 亚硫酸的酸性比氢硫酸的酸性弱 |
|
| B. | ab段反应是:SO2+2H2S═3S↓+2H2O |
|
| C. | 原H2S溶液的物质的量浓度为0.05mol/L |
|
| D. | b点对应的溶液导电性最强 |
考点:
二氧化硫的化学性质.
专题:
氧族元素.
分析:
H2S 饱和溶液中通入SO2,发生反应:SO2+2H2S=3S↓+2H2O,随着反应的进行,溶液酸性逐渐减弱,但恰好反应时,溶液呈中性,二氧化硫过量,与水反应生成亚硫酸,溶液酸性逐渐增强,根据图象可知恰好反应时消耗二氧化硫112mL,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性更强,以此解答该题.
解答:
解:A.由图象可知恰好反应时消耗二氧化硫112mL,n(SO2)=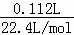 =0.005mol,由SO2+2H2S=3S↓+2H2O可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,溶液中亚硫酸为0.01mol,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性比氢硫酸更强,故A错误;
=0.005mol,由SO2+2H2S=3S↓+2H2O可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,溶液中亚硫酸为0.01mol,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性比氢硫酸更强,故A错误;
B.ab段pH在增大,由酸性到中性,则发生的反应是SO2+2H2S=3S↓+2H2O,故B正确;
C.由图可知,112mLSO2与硫化氢恰好完全反应,则n(SO2)=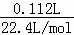 =0.005mol,由方程式可知n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为
=0.005mol,由方程式可知n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为 =0.1mol/L,故C错误;
=0.1mol/L,故C错误;
D.b点为中性,只有水,导电性最差,故D错误;
故选B.
点评:
本题考查硫元素化合物性质、化学反应图象等,明确发生的化学反应是解答的关键,注意A选项中应根据溶液物质的浓度相等时pH大小进行判断,学生容易根据已有知识回答为解答易错点,题目难度中等.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 常温下,将铁片置于过量的浓硝酸中:Fe+6H++3NO3﹣═Fe3++3NO2↑+3H2O |
|
| B. | 加热条件下,铜与浓硫酸反应:4H++SO42﹣+Cu |
|
| C. | 常温下,向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42﹣═BaSO4↓ |
|
| D. | 常温下,向稀硝酸中加入过量的铁片:3Fe+8H++2NO3﹣═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:
其中:a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物.
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用名称表示):
b ;c ;e ;
(2)如果a是一种常见气体,试推断这五种物质(用化学式表示):b ;c ;e .

查看答案和解析>>
科目:高中化学 来源: 题型:
已知C5H12O(属于醇类)的同分异构体的数目8种,有关下列说法:①其与氢氯酸取代的产物是8种②能氧化成醛的结构有4种③能发生消去的结构有7种,其中说法正确的组合是( )
|
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关环境问题都是由化学物质引起的,在下列组合中对应的化合物不正确的是( )
|
| A. | 温室效应:二氧化碳 | B. | 光化学烟雾:二氧化氮 |
|
| C. | 酸雨:二氧化碳 | D. | 臭氧层破坏:氟氯烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com