
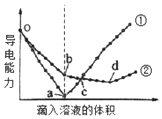
 在两份15mL、1mol/L的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份15mL、1mol/L的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | o-b段,发生的离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | bd段,发生的离子方程式:OH-+H+═H2O | |
| C. | c点,两溶液中阴、阳离子的浓度之和相等 | |
| D. | o-a段加入溶液的体积为20mL,则NaHSO4溶液的浓度为0.75mol/L |
分析 Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,据此分析.
解答 解:Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,
A.根据图知,a点为Ba(OH)2溶液和H2SO4恰好反应,H2SO4、NaHSO4溶液的物质的量浓度相等,则b点Ba(OH)2与NaHSO4等物质的量反应,生成硫酸钡、氢氧化钠和水,发生的离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O,故A正确;
B.bd段,是氢氧化钠与硫酸氢钠反应,发生的离子方程式:OH-+H+═H2O,故B正确;
C.c点两种溶液的导电能力相同,则两溶液中阴、阳离子所带电荷的浓度之和相等,故C错误;
D.o-a段反应方程式分别为H2SO4+Ba(OH)2=BaSO4↓+2H2O,硫酸与氢氧化钡的物质的量相同,则NaHSO4溶液的浓度为$\frac{1mol/L×0.015L}{0.02L}$=0.75mol/L,故D正确.
故选C.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及识图能力,明确发生的反应及各点溶液中溶质成分是解本题关键,注意:溶液导电能力与离子所带电荷的浓度成正比.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | CH3CH2CH3分子中的3个碳原子不可能在同一直线上 | |
| C. | 聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力开发太阳能,尽量减少化石燃料的使用 | |
| B. | 对废旧电池进行回收利用 | |
| C. | 农作物秸秆露天焚烧以制肥料 | |
| D. | 汽车使用尾气净化装置,减少有害气体排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬脂酸甘油酯和乙酸乙酯都属于酯类物质,都能发生皂化反应 | |
| B. | 制造纸张的原料棉花、制造毛皮大衣的原料皮革,它们的主要成分都是纤维素 | |
| C. | 在淀粉水解液中加过量NaOH,滴加碘水,如溶液未显蓝色,则证明淀粉水解完全 | |
| D. | 体积分数75%的乙醇溶液可用于医疗消毒,原理是乙醇使细菌的蛋白质发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫酸可以洗去锅炉水垢 | |
| B. | 用加热的方法可以杀死流感病毒 | |
| C. | 食盐既可做调味品,也可以做防腐剂 | |
| D. | 洗涤棉制品可以使用弱碱性洗涤剂或肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| B. | 标准状况下,2.24L NO与11.2L O2混合后气体的分子数小于NA | |
| C. | 120g熔融的NaHSO4中含阳离子总数为2NA | |
| D. | 用5mL 3mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com