
| A. | Na2CO3 | B. | HCl | C. | H2O | D. | NaOH |
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 消耗NaOH溶液的体积为0.5L | |
| B. | 产生气体的体积一定是4.48L | |
| C. | Cu、Cu2O与硝酸反应后剩余为0.5mol | |
| D. | Cu、Cu2O的物质的量之比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
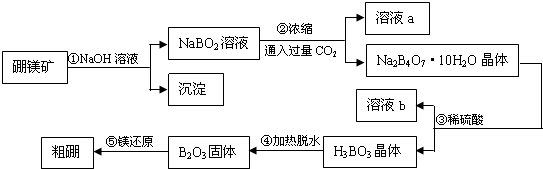
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向淀粉碘化钾溶液中滴加少量氯水,溶液变蓝,说明氯水中含有ClO- | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①中,电流计读数为零后,在甲中溶入 FeCl2固体,乙中的石墨电极为正极 | |
| B. | 装置②中,外电路通过 1mol 电子时,铜片质量减轻 64g | |
| C. | 装置③是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com