
| A. | 纯碱 | B. | 小苏打 | C. | 烧碱 | D. | 赤铁矿 |
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量时,左盘高,右盘低 | B. | 定容时,俯视读取刻度 | ||
| C. | 容量瓶洗净后未干燥 | D. | 定容时,液面超过了刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3和NxOy都属于酸性氧化物 | |
| B. | 实验室制取氯气时,先加热二氧化锰,后滴入浓盐酸 | |
| C. | 锶与镁、钙、钡同族,由于碳酸钙和碳酸钡都难溶,所以碳酸锶也难溶 | |
| D. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,所以NH3沸点低于PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量AlO${\;}_{2}^{-}$的溶液中:Na+、OH-、Cl-、CO${\;}_{3}^{2-}$ | |
| B. | 滴加紫色石蕊试液变红的溶液中:K+、Ba2+、CH3COO-、F- | |
| C. | 加入Al能放出H2的溶液中:K+、NH4+、NO3-、HCO3- | |
| D. | 1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液中通入少量SO2:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| B. | 漂白粉中滴加浓盐酸加热制取氯气:ClO-+Cl-+2H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Cl2+H2O | |
| C. | 将0.1mol•L-1的NH4Al(SO4)2溶液与0.2mol•L-1的Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═AlO2-↓+2BaSO4↓+2H2O | |
| D. | 含0.4molFeI2的溶液中通入0.3mol氯气:4Fe2++2I-+3Cl2═4Fe3++I2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
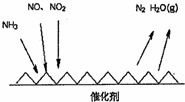 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com