
| 乙醇 | 1,2-二溴乙烷 | 醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
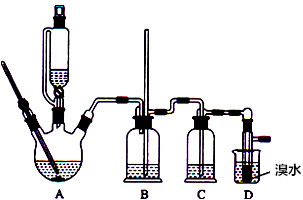
分析 装置A:乙醇在浓硫酸、加热条件下发生消去反应生成乙烯,浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,装置B:B为安全瓶,可以防止倒吸,装置D生成1,2-二溴乙烷,反应后容器内气压减小,1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,根据B中内外液面高低变化,可以判断是否发生堵塞,装置C:二氧化碳、二氧化硫能和氢氧化钠溶液反应,二氧化硫能与溴反应,盛放氢氧化钠溶液除去乙烯中的二氧化碳、二氧化硫,装置D:乙烯与溴反应生成1,2-二溴乙烷;溴易挥发,为防止污染空气,D装置之后需要连接盛放氢氧化钠溶液吸收尾气装置.
(1)三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下加热到170℃产生乙烯;
(2)1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,B为安全瓶,可以防止倒吸,根据玻璃导管中内外液面高低变化,可以判断是否发生堵塞;
(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,二氧化碳在水中溶解度小,浓硫酸既不能吸收二氧化碳,也不能吸收二氧化硫,饱和碳酸氢钠溶液不能吸收二氧化碳;
(4)因Br2能与Na2SO3溶液溶液反应,且1,2-二溴乙烷与水互不相溶,所以用Na2SO3溶液溶液吸收Br2,采用分液的方法分离.
解答 解:(1)A中乙醇发生消去反应生成乙烯,反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)1,2-二溴乙烷熔点为9℃,冷却容易析出晶体,堵塞玻璃导管,B为安全瓶,可以防止倒吸,根据玻璃导管中内外液面高低变化,可以判断是否发生堵塞,
故答案为:防止倒吸,判断装置是否堵塞;
(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,所以制取的乙烯气体中会含有CO2和SO2,而SO2具有还原性,也能使溴水褪色,故装置C中盛有的溶液需吸收乙烯中的杂质气体二氧化碳和二氧化硫的,水吸收二氧化碳能力弱,浓硫酸不吸收二氧化碳、二氧化硫,饱和碳酸氢钠溶液不吸收二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应被吸收,SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,不和乙烯反应,故选用氢氧化钠溶液,
故答案为:c;
(4)a.溴更易溶于1,2-二溴乙烷,用水无法除去溴,故a错误;
b.常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,但1,2-二溴乙烷在氢氧化钠水溶液、加热条件下容易发生水解反应,故b错误;
c.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,故c错误;
d.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,故d错误;
e.溴与Na2SO3溶液反应离子方程式为:Br2+SO32-+H2O═SO42-+2Br-+2H+,再分液除去,故e正确;
故答案为:e.
点评 本题考查有机物合成实验,主要考查了乙醇制备1,2-二溴乙烷,涉及制备原理、物质的分离提纯、实验条件控制、对操作分析评价等,是对基础知识的综合考查,需要学生具备扎实的基础,难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
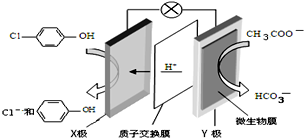 含乙酸钠和对氯酚(
含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如图所示.下列有关说法错误的是( )
)的废水可以利用微生物电池除去,其原理如图所示.下列有关说法错误的是( )| A. | Y极为该电池的负极 | |
| B. | X极的电极反应式为: +H++2e-═ +H++2e-═ +Cl- +Cl- | |
| C. | 可用硝酸酸化的硝酸银溶液验证正极产物 | |
| D. | 每处理1mol对氯酚,消耗8.2g乙酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的合成路线(其他无机试剂任选).已知
的合成路线(其他无机试剂任选).已知 .
.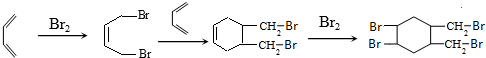 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
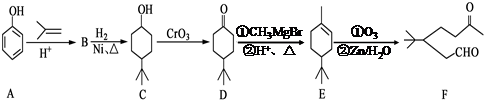
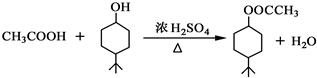 .
.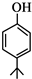 .同时满足下列条件的B的同分异构体(不包括B)共有11种:
.同时满足下列条件的B的同分异构体(不包括B)共有11种:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:C>D>A>B | |
| B. | A、C、D元素最高价氧化物的水化物间相互反应 | |
| C. | C、D、A、B四种元素的最高价化合价依次升高 | |
| D. | B元素在周期表中的位置为第二周第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
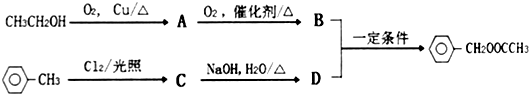
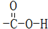 .
.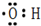 .
.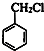 ,D的名称是苯甲醇.
,D的名称是苯甲醇. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | W得电子能力比Q强 | |
| B. | Z的氧化物能与水直接化合生成对应的酸 | |
| C. | 钠与Y可能形成的两种常见化合物阴阳离子个数比均为1:2 | |
| D. | X有多种同素异形体,而Y不存在同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com