

| A. | ①②④⑤ | B. | ①②③ | C. | ③④⑤ | D. | ②③⑤⑥ |
分析 根据U形管中现象的实质是锥形瓶内的气压高于大气压,锥形瓶内气压增大的原因,可能是化学反应生成了气体,也可能是物质溶解或化学反应放出热量,还可能是既生成气体又放出热量,据此分析来解答.
解答 解:U形管中现象的实质是锥形瓶内的气压高于大气压,锥形瓶内气压增大的原因,可能是化学反应生成了气体,也可能是物质溶解或化学反应放出热量,还可能是既生成气体又放出热量,
①硝酸铵晶体溶于水吸收热量,锥形瓶内的气体压强减小,故①错误;
②浓硫酸溶于水放热,锥形瓶内的气体压强增大,故②正确;
③NaOH粉末溶于水放热,锥形瓶内的气体压强增大,故③正确;
④氯化钠与水不反应,气体体积不变,故④错误;
⑤Na2O2与H2O反应2Na2O2+2H2O═4NaOH+O2↑,生成O2并放出热量,锥形瓶内的气体压强增大,故⑤正确;
⑥生石灰与H2O反应CaO+H2O=Ca(OH)2,放出热量锥形瓶内的气体压强增大,故⑥正确;
故选D.
点评 本题主要考查了物质与水作用的现象,充分理解物质溶于水时的放热情况与产生气体情况是解题的关键,另外记住物质溶于水吸放热情况,氢氧化钠、浓硫酸、过氧化钠、生石灰溶于水放热,而硝酸铵溶于水吸热,题目较基础,难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
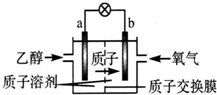 一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )| A. | a极为电池的正极 | |
| B. | 电池正极的电极反应:4H++O2+4e-═2H2O | |
| C. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| D. | 设每个电子所带电量为q库仑,则1 mol乙醇被氧化产生12q库仑的电量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A浓度表示该反应速率为1.6 mol/(L•min) | |
| B. | 若使容器体积变为1 L,则B的物质的量一定减小 | |
| C. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| D. | 若向容器再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
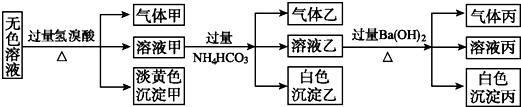
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
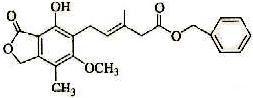
| A. | 一定条件下,既可以与Br2发生加成反应,又可以与Br2发生取代反应 | |
| B. | 1 mol该化合物最多可以与3 molNaOH反应 | |
| C. | 既可以催化加氢,又可以在稀硫酸存在下水解得2种有机物 | |
| D. | 可以与Na2CO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中的金属都是以化合态形式存在的 | |
| B. | 工业上可利用反应:Mg+2KCl═MgCl2+2K↑进行金属钾的冶炼 | |
| C. | 利用潮汐发电是将化学能转化为电能 | |
| D. | 将海水蒸干可以直接获得食用盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4O | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com