
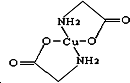
 Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:分析 (1)加热条件下,Cu和稀硫酸、氧气发生氧化还原反应生成硫酸铜和水,根据反应物、生成物和反应条件书写方程式;
(2)①硫酸根离子中S原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论确定S原子杂化方式;
②根据A的结构简式可知,A中酯基中的碳周围有一个碳双键和两个单键,另一个碳周围有四个单键,据此判断碳原子的杂化方式;
③1个氨基乙酸钠(H2N-CH2-COONa)中含有两个H-N键,两个C-H键,一个碳碳单键,一个碳氮单键,一个碳氧单键和一个碳氧双键,据此确定σ键的数目;
(3)一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为密置层,该晶体是由金属晶体,原子之间存在金属键;
(4)该晶体储氢后的晶胞结构与CaF2的晶胞结构结构相似,则在金属晶胞内部有8个H原子,该晶胞中含有1个Au原子、3个Cu原子,据此判断其化学式;若Cu原子与Au原子的距离为a cm,则晶胞棱长=$\sqrt{2}$acm,晶胞体积=( $\sqrt{2}$acm)3,晶胞密度=$\frac{\frac{M}{N{\;}_{A}}}{V}$.
解答 解:(1)加热条件下,Cu和稀硫酸、氧气发生氧化还原反应生成硫酸铜和水,根据反应物、生成物和反应条件书写方程式为2Cu+O2+2H2SO4(稀) $\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4(稀) $\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(2)①硫酸根离子中S原子价层电子对个数是4且不含孤电子对,S原子杂化方式为sp3,
故答案为:sp3;
②根据A的结构简式可知,A中酯基中的碳周围有一个碳双键和两个单键,另一个碳周围有四个单键,所以碳原子的杂化方式为sp2 sp3,
故答案为:sp2 sp3;
③1个氨基乙酸钠(H2N-CH2-COONa)中含有两个H-N键,两个C-H键,一个碳碳单键,一个碳氮单键,一个碳氧单键和一个碳氧双键,所以1mol氨基乙酸钠中含有的σ键的数目为8NA,
故答案为:8NA;
(3)一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为密置层,该晶体是由金属晶体,原子之间存在金属键;
故答案为:密置层;金属键;
(4)该晶体储氢后的晶胞结构与CaF2的晶胞结构结构相似,则在金属晶胞内部有8个H原子,该晶胞中含有Au原子个数=8×$\frac{1}{8}$=1、Cu原子个数=6×$\frac{1}{2}$=3,据此判断其化学式为H8AuCu3;
若Cu原子与Au原子的距离为a cm,则晶胞棱长=$\sqrt{2}$acm,晶胞体积=( $\sqrt{2}$acm)3,晶胞密度=$\frac{\frac{M}{N{\;}_{A}}}{V}$=$\frac{\frac{397}{{N}_{A}}}{(\sqrt{2}{a)}^{3}}$g/cm3=$\frac{397}{{N}_{A}({\sqrt{2}a)}^{3}}$g/cm3,
故答案为:H8AuCu3; $\frac{397}{{N}_{A}({\sqrt{2}a)}^{3}}$g/cm3.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子核外电子排布、原子杂化、空间构型判断、氧化还原反应等知识点,侧重考查学生分析计算能力,难点是晶胞计算,注意密度公式中各个字母含义,题目难度中等


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、淀粉的最简式都是CH2O | B. | 醋酸钠的分子式:CH3COONa | ||
| C. | CH4的电子式是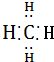 | D. | 丙烷分子的球棍模型是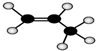 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
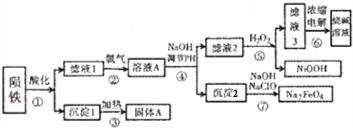
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的性状 | 温度/ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 通过灼热的铜网以除去H2中混有的O2 | |
| C. | Cu与浓硫酸反应终止后,冷却,向试管中加适量蒸馏水以观察水合铜离子的颜色 | |
| D. | pH小于7的雨水即为酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | |
| B. | 14C的原子结构示意图: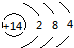 | |
| C. | N2分子的电子式: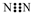 | |
| D. | 乙酸乙酯的结构简式为:CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
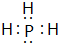 ; ⑨的最高价氧化物的对应的水化物
; ⑨的最高价氧化物的对应的水化物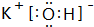 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,丁香油酚的结构简式为:
,丁香油酚的结构简式为: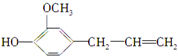 ,下列关于两者的说法正确的是( )
,下列关于两者的说法正确的是( )| A. | 均含酯基 | B. | 均含碳碳双键 | ||
| C. | 均含醇羟基和酚羟基 | D. | 均为芳香化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com