
| ||
| ||


科目:高中化学 来源: 题型:
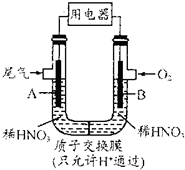 某化学小组构想将汽车尾气(NO、NO2)转化为重要化工原料HNO3,其原理如示意图,其中A、B为多孔材料.下列说法正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要化工原料HNO3,其原理如示意图,其中A、B为多孔材料.下列说法正确的是( )| A、电解质溶液中电流方向由B到A,电子流向与之相反 |
| B、电极A表面反应之一:NO-3e-+2H2O=NO3-+4H+ |
| C、电极B附近c(NO3-)增大 |
| D、该电池工作时,每转移4mole一消耗22.4 L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在25℃时,次氯酸的电离方程式及热效应可表示为:HClO(aq)═H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ?mol-1 |
| B、将20mL 1mol/L HClO与10mL 1mol/L NaOH混合后的溶液,一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) |
| C、已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO═HSO3-+ClO- |
| D、已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
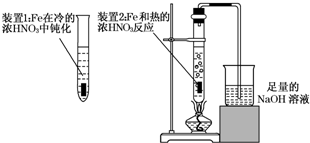 Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的甲烷、乙烯、乙炔充分燃烧,消耗的氧气的物质的量依次增多 | ||
| B、Wg葡萄糖充分燃烧后,燃烧产物经过足量的Na2O2充分反应,固体质量增加Wg | ||
C、乙酸和两种链状单烯烃混合物中氧的质量分数为a,则碳的质量分数是
| ||
| D、等物质的量的乙醇与丙烯酸(CH2=CH-COOH)充分燃烧,消耗的氧气的物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com