
【题目】硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
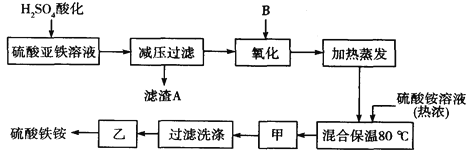
请回答下列问题:
(1)下列物质中最适合的氧化剂B是 ;
a.NaClO b.H2O2c.KMnO4d.K2Cr2O7
反应的离子方程式 。
(2)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,能否用酸性的KMnO4溶液?并说明理由 。(可用文字或方程式说明)
(3)检验硫酸铁铵中NH4+的方法是 。
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
【答案】(1)b(3分);H2O2+2Fe2++2H+=2Fe3++2H2O(3分)
(2)不能,因为H2O2和Fe2+均能使酸性KMnO4溶液褪色(3分)
(3)在试管中加入少量样品和NaOH固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色(3分) (4)Fe2(SO4)3·2(NH4)2SO4·2H2O(3分)
【解析】试题分析:(1)由于不能引入杂质,则选择绿色氧化剂双氧水,答案选b,反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O。
(2)由于H2O2和Fe2+均能使酸性KMnO4溶液褪色,所以不能用酸性高锰酸钾溶液检验。
(3)铵盐能与氢氧化钠反应发生碱性气体氨气,则检验铵跟离子的实验方法是在试管中加入少量样品和NaOH固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色。
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀,该沉淀是氢氧化铁,物质的量是2.14g÷107g/mol=0.02mol;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完全反应,这说明硫酸根离子的物质的量是0.05mol,因此该硫酸铁铵中铁离子与硫酸根离子的个数之比是2:5,所以不含结晶水的化学式为Fe2(SO4)3·2(NH4)2SO4。每一份中结晶水的质量是7.00g—0.01mol×664g/mol=0.36g,物质的量是0.02mol,所以化学式为Fe2(SO4)3·2(NH4)2SO4·2H2O。


科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
① ![]() ② (CH3)2CHCH2Cl ③ (CH3)3CCH2Cl ④ CHCl2-CHBr2 ⑤
② (CH3)2CHCH2Cl ③ (CH3)3CCH2Cl ④ CHCl2-CHBr2 ⑤ ![]() ⑥ CH2Cl2
⑥ CH2Cl2
A.①③⑥ B.②③⑤ C.全部 D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丙酮通常是无色液体,可溶于水,密度小于1 g/mL,沸点约为56 ℃。要从水与丙酮的混合物里将丙酮分离出来,下列方法中,最合理的是( )
A.蒸馏
B.升华
C.过滤
D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是电解饱和氯化钠溶液示意图。图2中,x轴表示实验时流入阴极的电子的物质的量,y轴表示
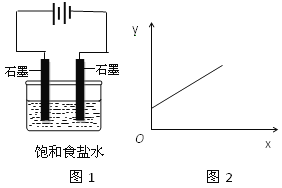
A.n(Na+) B.n(Cl-)
C.c(OH-) D.c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安徽古代科学家方以智在其《物理小识》卷七《金石类》中指出:有硇水者,剪银块投之,则旋而为水。其中的“硇水”指 ( )
A. 硝酸 B. 硫酸 C. 盐酸 D. 醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)铜是与人类关系非常密切的有色金属。已知:常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+ =Cu2++Cu。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为: ,某同学实验时却有黑色物质出现,这种黑色物质的化学式为: 。
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:
a.2Cu2++4I- =2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I- =2CuCl↓(白色)+I2。
为顺利观察到白色沉淀可以加入的最佳试剂是 。
A.SO2 B.苯 C.NaOH溶液 D.乙醇
(3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH)。
①已知NH5是离子晶体且所有原子都达到稀有气体的稳定结构,请写出NH5的电子式: 。
②写出CuH在过量稀盐酸中有气体生成的离子方程式 。
③将CuH溶解在适量的稀硝酸中, 完成下列化学方程式
![]()
(4)常温下,向0.20 mol L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH = 6时,c(Cu2+)=________________mol.L1。
[已知:![]()
![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是
A. 4 s时c(B)为0.38 mol/L
B. 830℃达平衡时,A的转化率为20%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数为0.4
A(g)+B(g)的平衡常数为0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的说法错误的是
A. 热稳定性:HCl> HI B. 原子半径:Na> Mg
C. 酸性:H2SO3>H2SO4。 D. 结合质子能力:S2-> Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com