
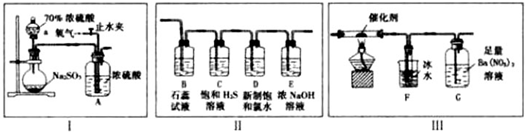
分析 (1)根据图示可知,仪器a为分液漏斗;
(2)二氧化硫、仪器不溶于浓硫酸,也不与浓硫酸反应,在装置A中会产生气泡,根据产生气泡速度可以控制O2和SO2的流速;
(3)①二氧化硫为酸性氧化物,能够使紫色石蕊试液变红;装置C中的氢硫酸与二氧化硫反应生成硫单质,体现了二氧化硫的氧化性;
②二氧化硫的漂白性是暂时的,加热后会恢复原色,而氯水的漂白是永久的,据此设计检验方案;
(4)①二氧化硫和三氧化硫是大气的污染物,需要用氧气将装置中二氧化硫和三氧化硫排出,从而被完全吸收;
②装置G的作用是吸收二氧化硫,联系二氧化硫的化学性质对各选项进行判断;
③三氧化硫的熔沸点降低,所以二氧化硫和三氧化硫的混合气体通过装置F后,三氧化硫变成固体,即装置F增加的mg为反应后生成的三氧化硫的质量,根据n=$\frac{m}{M}$计算出三氧化硫的物质的量,从而得出被氧化的二氧化硫的物质的量;
装置G中二氧化硫与硝酸钡反应生成硫酸钡沉淀,产生的ng白色沉淀为硫酸钡,根据n=$\frac{m}{M}$计算出生成硫酸钡的物质的量,根据S原子守恒可知反应后剩余二氧化硫的物质的量,然后计算出二氧化硫的转化率.
解答 解:(1)装置图中,充分浓硫酸的仪器a的名称为分液漏斗,故答案为:分液漏斗;
(2)装置A中盛放的是浓硫酸,可以将气体充分混合、并干燥气体,另外还可以根据产生气泡速度控制通入的氧气和二氧化硫的流速,通过观察气泡以便控制O2和SO2的流速,
故答案为:通过观察气泡以便控制O2和SO2的流速;
(3)①装置B中盛放的是石蕊试液,二氧化硫溶于水生成弱酸亚硫酸,导致石蕊试液由紫色变为红色;装置C中盛放的是饱和硫化氢气体,硫化氢能够与二氧化硫反应生成S单质,该反应中二氧化硫化合价降低被还原,表现了氧化性,
故答案为:溶液由紫色变为红色;氧化;
②经验证D瓶中的溶液能使品红试液褪色,二氧化硫的漂白性是暂时的、不稳定的,加热后会褪色,而氯气的漂白利用的是次氯酸的强氧化性,氯水的漂白是永久的,所以检验D瓶中含有SO2还是含有氯水的方法为:取褪色后的溶液加热,若溶液变红,则溶液中含有二氧化硫,否则含有氯水,
故答案为:取褪色后的溶液加热,若溶液变红,则溶液中含有二氧化硫,否则含有氯水;
(4)①使残留在装置中的SO2和SO3被充分吸收,故答案为:使残留在装置中的SO2和SO3被充分吸收;
②装置G的作用是吸收并测定SO2,避免造成空气污染,但是反应中会生成有毒的NO,
a.足量BaC12溶液:氯化钡溶液不与二氧化硫反应,不能用氯化钡溶液代替硝酸钡,故a错误;
b.足量Ba(OH)2溶液能够与二氧化硫反应,可以用氢氧化钡溶液吸收二氧化硫,反应中没有有毒气体生成,故b正确;
c.铁离子能够将二氧化硫氧化成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀,所以可用足量FeC13和BaC12的混合液代替硝酸钡溶液,反应中不会生成有毒气体,故c正确;
d.足量NaHSO3溶液:亚硫酸氢钠溶液不与二氧化硫反应,无法代替装置G,故d错误;
故答案为:bc;
③由于三氧化硫的熔沸点降低,所以二氧化硫和三氧化硫的混合气体通过装置F后,三氧化硫变成固体,即装置F增加的mg为反应后生成的三氧化硫的质量,则反应生成的三氧化硫的物质的量为:$\frac{mg}{80g/mol}$=$\frac{m}{80}$mol,所以反应中被氧化的二氧化硫为$\frac{m}{80}$mol,
装置G中二氧化硫与硝酸钡反应生成硫酸钡沉淀,产生的ng白色沉淀为硫酸钡,生成硫酸钡的物质的量为:$\frac{ng}{233g/mol}$=$\frac{n}{233}$mol,根据S原子守恒,反应后剩余二氧化硫的物质的量为$\frac{n}{233}$mol,所以二氧化硫的转化率为:$\frac{\frac{m}{80}mol}{\frac{m}{80}mol+\frac{n}{233}mol}$×100%=$\frac{\frac{m}{80}}{\frac{m}{80}+\frac{n}{233}}×100%$,
故答案为:$\frac{\frac{m}{80}}{\frac{m}{80}+\frac{n}{233}}×100%$.
点评 本题考查了性质实验方案的设计,题目难度中等,明确二氧化硫的性质及实验目的为解答关键,注意掌握性质实验方案设计与评价的原则,(4)②为难点、易错点,需要明确装置中质量变化的含义,试题培养了学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②④ | C. | ①②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
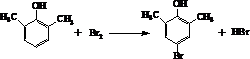 .
. .
.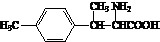 .
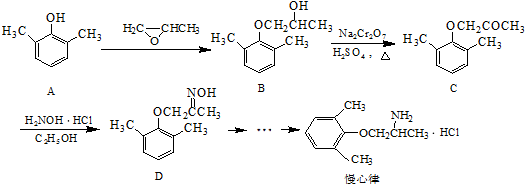
.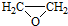 ).写出以邻甲基苯
).写出以邻甲基苯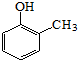 )和乙醇为原料制备
)和乙醇为原料制备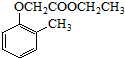 的合成路线流程图(无机试
的合成路线流程图(无机试查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 有机物A不能使溴的四氯化碳溶液褪色 | |
| B. | 胡妥油可以发生加成反应和氧化反应 | |
| C. | 有机物A与胡妥油互为同系物 | |
| D. | 1 mol胡妥油完全燃烧消耗313.6 L的氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.5 | 8.0 |
| Cu2+ | 5.2 | 6.7 |
| Fe2+ | 5.8 | 8.8 |
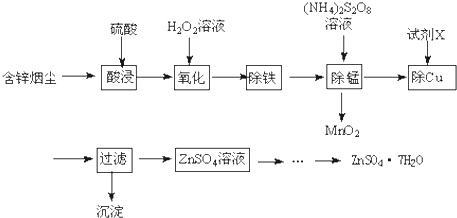
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
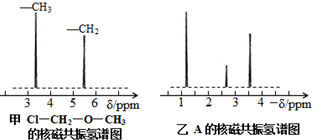
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片和稀盐酸反应 | B. | 氢氧化钡晶体和氯化铵反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 甲烷在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实 验 | 现 象 | 结论 | |
| A | 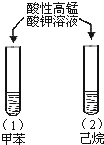 | 试管(1)中紫色褪去, 试管(2)中紫色未褪 | 苯环使甲基的活性增强 |
| B | 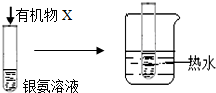 | 试管内壁有 银镜生成 | 有机物X中一定含有醛基 |
| C | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 | 未见砖红色沉淀 | 淀粉未水解 |
| D | 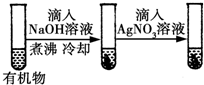 | 最后一只试管中有浅黄色沉淀 | 有机物中含有溴原子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com