
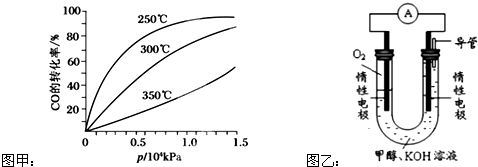
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| x2 |
| (2a-x)��(a-x) |


 Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
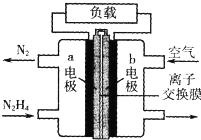
| A��b������������Ӧ |
| B��OH-��b���ƶ� |
| C���ŵ�ʱ��������a��������������b�� |
| D��a���ĵ缫��Ӧʽ��N2H4+4OH--4e-=N2��+4H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ȼ������Ҫ�ɷ� |
| B�������� |
| C����̼�������������л��� |
| D���������ڹ����������ܷ���ȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������¶ȣ��ٽ�CO32-ˮ�⣬pH���� |
| B������Ũ�ȣ�c��Na+��=2[c��CO32-��+c��HCO3-��+c��H2CO3��] |
| C������Ũ�ȣ�c��Na+��+c��H+��=c��HCO3-��+c��CO32-��+c��OH-�� |
| D������Ũ�ȣ�c��Na+����c��CO32-����c��H+����c��OH-����c��HCO3-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������������淴Ӧ���ʲ��� |
| B������Ӧ��ϵ��ѹǿ������Ӧ����һ������ |
| C�������¶ȣ���Ӧ���ʼӿ죬��Ӧ�ų���������С |
| D������ԭ����н��У���Ӧ�ų����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��OF2 |
| B��CO2 |
| C��SO2 |
| D��NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ߵ��� | B����ͭǮ |
| C����ͨӲ�� | D��̼�ظ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Ȼˮ������Al��OH��3���壬����������ˮ�������� |
| B��SO2��Ư���ԣ���ҵ�ϳ�������Ư��ֽ�� |
| C�����ʹ���а뵼�����ܣ������Ƴɹ��� |
| D��Fe2O3��һ�ֺ���ɫ��ĩ����������ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��920 kJ |
| B��557 kJ |
| C��436 kJ |
| D��188 kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com