
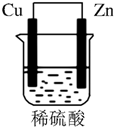
 由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:
由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:分析 形成原电池时,锌为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,铜为原电池正极,发生还原反应,电极方程式为2H++2e-═H2↑,电子从负极流向正极,溶液中阳离子向正极移动,结合电极方程式和电子守恒计算.
解答 解:(1)形成原电池时,铜为原电池正极,发生还原反应,电极方程式为2H++2e-═H2↑,则Cu上有气泡生成;锌为负极,逐渐溶解,锌失电子发生氧化反应,电极方程式为Zn-2e-═Zn2+,
故答案为:Cu;还原;有气泡生成;2H++2e-═H2↑;Zn;氧化;锌逐渐溶解;Zn-2e-═Zn2+;
(2)Cu为正极,Zn为负极,溶液中氢离子向正极移动;电子由负极流向正极,即由Zn极流向Cu极,
故答案为:Cu;Zn;Cu;
(3)铜电极方程式为2H++2e-═H2↑,n(H2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,转移0.3mol电子,
①已知电极方程式为Zn-2e-═Zn2+,转移0.3mol电子,消耗0.15mol锌,则消耗的锌为0.15mol×65mol/L=9.75g;
故答案为:9.75g;
②转移的电子数为0.3NA个;
故答案为:0.3NA;
③硫酸完全消耗,则n(H2)=n(H2SO4),则原来硫酸的物质的量为0.15mol,
所以原硫酸的物质的量浓度是c=$\frac{n}{V}$=$\frac{\underline{\;0.15mol\;}}{0.2L}$=0.75mol/L;
故答案为:0.75mol/L.
点评 本题考查了原电池原理、物质的量的计算等知识点,侧重于学生的分析能力和计算能力的考查,明确电极上电极反应、物质之间的关系即可解答,难度不大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:解答题
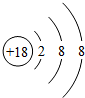
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ⑨ | ④ | ⑤ | ⑩ | ⑥ | ⑦ | ⑧ |
 ;
; ,④元素与⑦元素形成化合物的电子式
,④元素与⑦元素形成化合物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去NaCl晶体中少量KNO3,可以将混合物制成热的饱和溶液,然后冷却结晶,过滤,洗涤,干燥 | |
| B. | 在食醋总酸含量测定实验中,配制NaOH标准溶液后需要用邻苯二甲酸氢钾对该溶液浓度进行标定 | |
| C. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径.工业从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 | |
| D. | 在洁净试管中加入2mL 10% NaOH溶液,再加入等量的CuSO4溶液,制得的新制氢氧化铜悬浊液可用于检验糖尿病人尿液中葡萄糖含量是否偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3:0.002 mol•L-1•s-1 | B. | H2O:0.0015 mol•L-1•s-1 | ||
| C. | NO:0.0015 mol•L-1•s-1 | D. | O2:0.00125 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
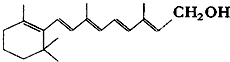 已知维生素A1的键线式如下,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来.
已知维生素A1的键线式如下,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4=H2++SO42- | B. | NaOH=Na++O2-+H+ | C. | Ba(OH)2=Ba2++OH2- | D. | CaCl2=Ca2++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 对石油进行分馏可以得到许多苯的同系物 | |
| C. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的 | |
| D. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com