
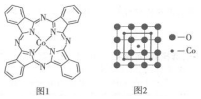
 根据所学的物质结构的相关知识回答下列问题:
根据所学的物质结构的相关知识回答下列问题:分析 (1)1~36号元素原子核外电子排布中未成对电子数最多的元素,故元素原子3d、4s均为半满;
(2)等电子体是指具有相同价电子总数和原子总数的分子或离子;
(3)氢键的存在,使熔沸点升高,据此解答;
(4)结构中N原子为3价,已经形成三根键的氮原子对钴的价态无贡献,酞菁钴中三种非金属原子为C、N、H,同周期自左而右电负性增大,非金属性越强电负性越大,金属的电负性小于非金属;根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数;
(5)大黑色球为O原子,小黑球棱上占$\frac{1}{4}$,均摊法计算判断.
解答 解:(1)1~36号元素原子核外电子排布中未成对电子数最多的元素,故元素原子3d、4s均为半满,元素原子的价电子构型为3d54s1,
则其基态原子的核外电子排布式[Ar]3d54s1,原子核外共24个电子,为Cr元素;
故答案为:Cr;
(2)NO3-中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3-是等电子体,
故答案为:SO3;
(3)过氧化氢和硫化氢都属于分子晶体,且相对分子质量均为3 4,过氧化氢分子中氧原子的电负性大,所以在过氧化氢分子间存在氢键,氢键的存在使过氧化氢分子沸点显著提高,
故答案为:过氧化氢分子间存在氢键,而硫化氢没有;
(4)已经形成三根键的氮原子对钴的价态无贡献,由图1可知结构中形成两根Co-N键,所以钴的价态为+2价,酞菁钴中三种非金属原子为C、N、H,同周期自左而右电负性增大,非金属性越强电负性越大,故电负性N>C>H,金属的电负性小于非金属,所以N>C>H>Co,形成了双键的N原子的杂化轨道类型为sp2杂化,全部形成单键的N原子的杂化轨道类型为sp3杂化,
故答案为:+2;N>C>H>Co;sp2杂化、sp3杂化;
(5)由氧化物晶胞结构可知晶胞中Co、O原子数目之比,Co、O原子数目之比为(1+4×$\frac{1}{4}$):4=1:2,
故答案为:CoO2.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、等电子体、电负性、晶胞计算等,(4)为易错点,读取图中信息是解答关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
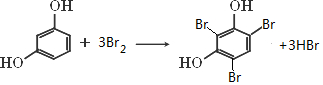
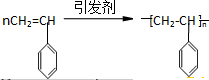
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
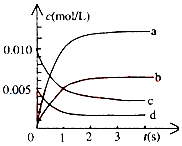 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,(1)以上元素中在自然界有游离态存在的是N、S、Fe元素(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
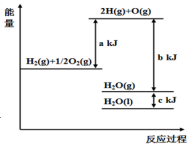
| A. | 1 mol H2(g)与$\frac{1}{2}$ mol O2(g)所具有的总能量比1 mol H2O(g)所具有的总能量高 | |
| B. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| C. | 2 mol H(g)与1 mol O(g)生成1 molH2O(g)所放出的热量是b kJ | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=2(b+c-a)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
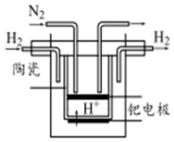 氮的固定对工农业及人类生存具有重大意义.
氮的固定对工农业及人类生存具有重大意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com