
分析 (1)脂为高级脂肪酸甘油酯;
(2)蛋白质的水解产物为氨基酸;
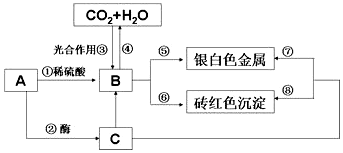
A是人体能消化的一种天然高分子化合物,由转化关系可知,A为淀粉,水解生成B为葡萄糖,水解生成C为麦芽糖,B、C中均含-CHO,以此解答(3)~(4).
解答 解:(1)油脂为高级脂肪酸甘油酯,在酸性和碱性条件下水解的共同产物是甘油(或丙三醇),故答案为:甘油(或丙三醇);
(2)蛋白质的水解产物为氨基酸,官能团为-NH2、-COOH,故答案为:-NH2、-COOH;
A是人体能消化的一种天然高分子化合物,由转化关系可知,A为淀粉,水解生成B为葡萄糖,水解生成C为麦芽糖,B、C中均含-CHO,
(3)1molB完全氧化时可以放出2804kJ的热量,其氧化的热化学方程式为C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-2804kJ,
故答案为:C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-2804kJ;
(4)设计实验证明A通过反应①已经全部水解,其操作方法、现象和结论为取少量淀粉水解后的溶液,向其中加入碘水,若溶液不变蓝证明淀粉已经全部水解,
故答案为:取少量淀粉水解后的溶液,向其中加入碘水,若溶液不变蓝证明淀粉已经全部水解.
点评 本题考查较综合,涉及油脂、蛋白质、糖类的基本性质及应用以及淀粉水解实验等,为高频考点,侧重考查学生的分析能力,综合性较强,题目难度不大,注意有机物的结构与性质.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
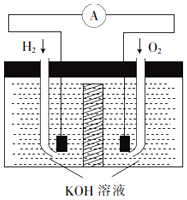 氢氧燃料电池是符合绿色化学理念的新型发电装置.其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置.其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 项目 | 分析 |
| A | 制备乙烯、制备硝基苯 | 实验时均用到了温度计 |
| B | 乙烯制备乙醇、氯乙烷制备乙醇 | 属于同一反应类型 |
| C | 丙烯可以使溴水和酸性高锰酸钾溶液褪色 | 褪色原理不同 |
| D | 乙醇燃烧、乙醇使重铬酸钾变色 | 均为氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/(mol•L-1) | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水浴加热 | B. | 将稀硫酸改为98%的浓硫酸 | ||
| C. | 滴加少许CuSO4溶液 | D. | 改用铁粉并振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色植物的光合作用是把热能转化为化学能的过程 | |
| B. | 生物能是与化学反应无关的一种能源 | |
| C. | 化学能只能以热能的形式释放 | |
| D. | 葡萄糖在人体内的氧化是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com