
分析 6HCl+KClO3=KCl+3Cl2+3H2O中,Cl元素的化合价由+5价降低为0,Cl元素的化合价由-1价升高为0,以此来解答.
解答 解:6HCl+KClO3=KCl+3Cl2+3H2O中,Cl元素的化合价由+5价降低为0,Cl元素的化合价由-1价升高为0,则氧化剂为KClO3,还原剂为HCl,且6molHCl中只有5mol作还原剂,可知氧化剂和还原剂的物质的量之比为1:5,所以消耗 0.1mol 氧化剂,则被氧化的还原剂的物质的量是0.5mol,
故答案为:HCl;0.5.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意部分HCl作酸,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
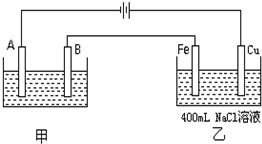 如图为相互串联的甲、乙两个电解池.试回答:
如图为相互串联的甲、乙两个电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | NaHCO3的热稳定性好 | |
| B. | 如图所示转化涉及的反应都是氧化还原反应 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
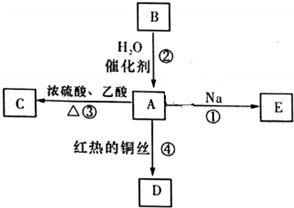 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com