
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
| 编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲 | 0.10mol/L H2SO4溶液/mL | 乙 |
| 1 | 25℃ | 10.0 | 0 | 10.0 | |
| 2 | 25℃ | 5.0 | a | 10.0 | |
| 3 | 45℃ | 10.0 | 0 | 10.0 |
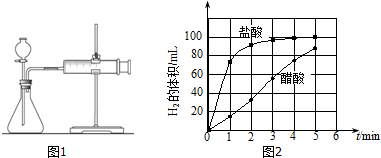
分析 (1)①要探究酸的强弱对酸与镁条反应速率的影响,则必须保持其他影响反应速率的因素保持一致,据此分析C的数值;
②据图可知,是要通过测量在相同的时间内收集到的氢气体积的大小来测量反应速率,据此分析反应开始后的操作;
③通过图象来分析单位时间内氢气的体积的变化可知醋酸、盐酸与镁条反应的速率的变化情况;
(2)①Na2S2O3溶液与稀H2SO4反应生成二氧化硫和硫沉淀;
②当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致;要探究Na2S2O3溶液浓度不同对反应速率的影响,则加入的Na2S2O3溶液的体积不同,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积相同;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短.
解答 解:(1)①要探究酸的强弱对酸与镁条反应速率的影响,则必须保持其他影响反应速率的因素保持一致,故醋酸和盐酸的浓度应相同,故C也应为1.0mol/L,
故答案为:1.0;
②据图可知,是要通过测量在相同的时间段内收集到的氢气体积的大小来测量反应速率,故在反应开始后,应每隔1min记录一次生成H2的体积,
故答案为:每隔1min记录一次生成H2的体积;
③通过图象分析可知,单位时间内醋酸与镁条反应生成氢气的体积变化很小,即醋酸与镁条的反应速率变化不大;而盐酸与镁条的反应一开始很快,一段时间后,单位时间内生成的氢气的体积明显变小,即反应速率明显减小,
故答案为:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小;
(2)醋酸的电离程度是已电离的电解质分子数占原来总分子数的百分比,故要求醋酸的电离程度,故应测出醋酸溶液的浓度和溶液中H+的浓度.
①Na2S2O3溶液与稀H2SO4反应生成二氧化硫和硫沉淀,其反应的离子方程式为:S2O32-+2H+═S↓+H2O+SO2↑;
故答案为:温度;
②当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,通过比较实验①③的反应条件可知,实验①③可探究温度对反应速率的影响;实验①②中的Na2S2O3溶液的加入体积不同,故要探究Na2S2O3溶液浓度不同对反应速率的影响,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积相同,故甲应为V(蒸馏水)/mL,a的值为5.0;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短,故乙要测量的物理量是出现浑浊的时间/min;
故答案为:温度;V(蒸馏水)/mL;5.0;出现浑浊的时间/min.
点评 本题考查了影响反应速率的因素的探究,应注意的是当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,综合性较强,难度中等,侧重于考查学生的实验探究能力和对基础知识的应用能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 向浓氨水中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体 | |
| B. | 为除去Mg(OH)2固体中少量Ca(OH)2,可用饱和MgCl2溶液多次洗涤后,再水洗、干燥 | |
| C. | 向溶液X中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉淀,说明溶液X中含有CO32- | |
| D. | 卤代烃Y与NaOH醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃Y中含有氯原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
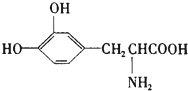 L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下
L-多巴胺是一种有机物,它可以用于帕金森综合症的治疗,其结构简式如下| A. | 它属于α-氨基酸,既具有酸性,又具有碱性 | |
| B. | 它遇到Fe2(SO4)3溶液显紫色 | |
| C. | 他可以两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环 | |
| D. | 它既与酸反应又与碱反应,等物质的量的L-多巴胺最多消耗NaOH与HCl物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
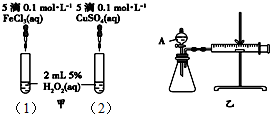 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A. | 实验中H2O2分解的速率为(1)>(2) | |
| B. | 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率 | |
| C. | H2O2分解的热化学方程式2H2O2(l)═2H2O(l)+O2(g)△H>0 | |
| D. | 图甲中(1)、(2)两个实验中H2O2分解的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷 | B. | 乙烯 | C. | 乙炔 | D. | 苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol NaOH中含有的阴离子数目为0.1NA | |
| B. | 1 L0.05mol?L-1 CH3 COOH溶液中含有的H+数目为0.05NA | |
| C. | 标准状况下,44.8 LCCl4含有的分子数为2NA | |
| D. | 反应:ClO3-+5Cl-+6H+=3Cl2+3H2O中,每生成1mol Cl2,转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com