
| A. | 将分别蘸有浓硝酸和浓氨水的玻璃棒相互靠近时,有白烟生成 | |
| B. | 硝酸具有酸的通性,如果与活泼金属反应,会有H2生成 | |
| C. | 浓硝酸能使活泼金属如铝、镁、锌、铁等发生“钝化” | |
| D. | 常温下,铜与稀HNO3反应很慢,是因为发生了“钝化” |
分析 A.均易挥发,二者反应生成硝酸铵固体;
B.硝酸属于氧化性酸,它与活泼金属反应不会生成H2;
C.常温下,浓硝酸能使铝、铁等表面氧化生成致密的氧化物保护膜,阻止内部金属继续反应,但是镁、锌等是没有此现象的;
D.铜不会发生钝化.
解答 解:A.将分别蘸有浓硝酸和浓氨水的玻璃棒相互靠近时,均易挥发,二者反应生成硝酸铵固体,观察到有白烟生成,故A正确;
B.硝酸属于氧化性酸,它与活泼金属反应不会生成H2,一般生成氮的氧化物,故B错误;
C.常温下,浓硝酸能使铝、铁等表面氧化生成致密的氧化物保护膜,阻止内部金属继续反应,但是镁、锌等是没有此现象的,则浓硝酸能使活泼金属如铝、铁发生“钝化”现象,故C错误;
D.常温下,铜与稀HNO3反应很慢,与金属活泼性,硝酸的浓度等有关,铜不会发生钝化,故D错误;
故选A.
点评 本题考查物质的性质及反应,为高考常见题型,侧重于学生的分析能力和应用能力的考查,把握物质的性质、浓度与反应的关系为解答的关键,注意钝化的理解与应用,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
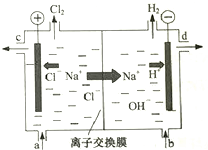 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 200 mL 0.4 mol•L-1AlCl3溶液 | ||
| C. | 50 mL 1.6 mol•L-1NaCl溶液 | D. | 25 mL 0.8 mol•L-1HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
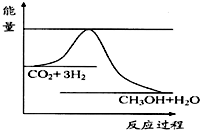 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
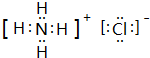 ;I分子的空间构型为直线形.
;I分子的空间构型为直线形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
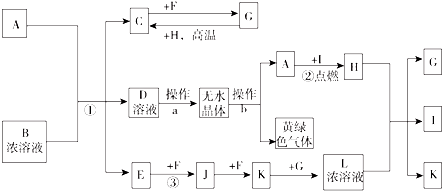
 在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题:
在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
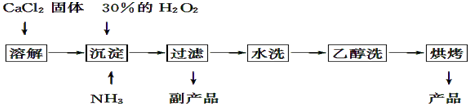
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com