
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.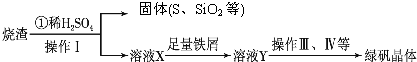
分析 (1)①根据平衡常数的表达式公式写出该反应的平衡常数表达式;
②根据达到平衡状态,正逆反应速率相等,各组分的浓度不变进行判断;
(2)①根据原电池工作原理分析负极、正极发生的反应;
②根据电流方向判断氢离子的移动方向;反应原理为二氧化硫、氧气和水反应生成硫酸;
(3)①根据在酸性条件下反应,反应物一定有氢离子,然后根据电子守恒和质量守恒配平方程式;
②根据反应结束时滴入高锰酸钾溶液溶液后颜色变化判断滴定终点;
③根据反应方程式及高锰酸钾的物质的量计算出产品中FeSO4•7H2O的质量分数.
解答 解:(1)A.v(SO2)=v(SO3),没有告诉正逆反应,无法判断正逆反应速率是否相等,故A错误;
B.反应方程式两边都是气体,气体的化学计量数之和不相等,气体的平均相对分子量是个变化的量,混合物的平均相对分子质量不变,说明正逆反应速率相等,达到了平衡状态,故B正确;
C.反应方程式两边都是气体,气体的质量始终不变,所以混合气体质量不变,不能判断是否达到平衡状态,故C错误;
D、各组分的体积分数不变,正逆反应速率相等,说明达到了平衡状态,故D正确;
故选:BD;
(2)①该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极,所以B极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
②原电池放电时,氢离子由负极B移向正极A,电池总反应式为:2SO2+O2+2H2O═2H2SO4,
故答案为:B;A;2SO2+O2+2H2O═2H2SO4;
(3)①用硫酸酸化的0.01mol/L KMnO4溶液,所以反应物中一定有氢离子,高锰酸根离子化合价由+7变为+2,降低了5价,亚铁离子与+2变为+3,升高了1价,所以高锰酸根离子系数为1、亚铁离子系数为5,根据电荷守恒、质量守恒配平氢离子、水,配平后的方程式为:5Fe2++1MnO4-+8H+═5Fe3++1Mn2++4H2O,
故答案为:5;1;8;H+;5;1;4;H2O;
②当亚铁离子与高锰酸钾离子完全反应后,再滴入一滴高锰酸钾溶液,溶液会呈淡紫色,据此判断滴定终点,
故答案为:滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色;
③25mL待测液消耗的高锰酸钾的物质的量为:0.01mol/L×0.04L=0.0004mol,
5.7g产品配成250mL溶液消耗高锰酸钾的物质的量为0.0004mol×$\frac{250}{25}$=0.004mol,
根据反应:5Fe2++1MnO4-+8H+═5Fe3++Mn2++4H2O,硫酸亚铁的物质的量为:0.004mol×5=0.02mol,
所以样品中含有的FeSO4•7H2O的质量为:278g/mol×0.02mol=5.56g,
FeSO4•7H2O的质量分数为:$\frac{5.56g}{5.7g}$×100%≈97.5%,
故答案为:0.975或97.5%.
点评 本题所以黄铜矿为载体考查化学平衡常数及平衡状态的判断、燃料电池、氧化还原反应及滴定的相关知识,涉及的题量较大,难度稍大.


科目:高中化学 来源: 题型:填空题
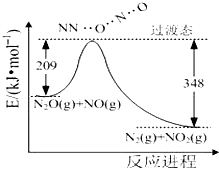 氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LH2O含有的分子数为NA | |
| B. | 1molAl3+离子含有的核外电子数为3NA | |
| C. | 3mol Fe在高温下与足量的水蒸汽反应转移的电子数为8NA | |
| D. | 1molNa2O2与足量的水反应失去电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成氯气的相对分子质量为71 | B. | 生成1 mol氯化钾转移5 NA个电子 | ||
| C. | 生成氯化钾的摩尔质量为76 g/mol | D. | 1molH37Cl参加反应转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 向该体系中充入18O2,一段时间后18O只存在于SO3中 | |
| C. | 生成物的总能量大于反应物的总能量 | |
| D. | 将该反应设计成原电池,放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
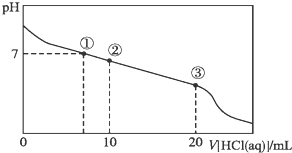
| A. | 点①所示溶液中,溶质为未反应完的CH3COONa、生成的CH3COOH和NaCl,微粒之间的关系为:c(CH3COOH)>c(Cl-)>c(OH-)=c(H+) | |
| B. | 点②所示溶液中,醋酸钠有一半与盐酸反应,微粒之间的关系为:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中,醋酸钠与盐酸恰好完全反应,微粒之间的关系为:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中有可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
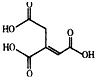
| A. | 化学式为C6H6O6 | |
| B. | 乌头酸能发生水解反应和加成反应 | |
| C. | 乌头酸能使酸性高锰酸钾溶液褪色 | |
| D. | 含1mol乌头酸的溶液最多可消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减压 | B. | 加压 | C. | 适当降温 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$(10-9+10-11)mol/L | B. | 2×10-11 mol/L | ||
| C. | (10-9+10-11)mol/L | D. | $\frac{1}{2}$(10-5+10-3)mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com