
| A. | ②>④>③>① | B. | ①>②>④>③ | C. | ①>②>③>④ | D. | ③>②>④>① |
分析 AgCl饱和溶液中存在AgCl(aq)?Ag+(aq)+Cl-(aq),AgCl的溶解度大小取决于溶液中c(Ag+)或c(Cl-),从平衡移动的角度分析.
解答 解:根据c(Ag+)或c(Cl-)大小比较AgCl的溶解度,①,c(Ag+)或c(Cl-)越小,AgCl的溶解度越大,
①20mL蒸馏水,c(Ag+)或c(Cl-)为0;
②30mL 0.03mol/L HCl溶液中c(Cl-)=0.03mol/L;
③40mL 0.05mol/L AgNO3溶液中c(Ag+)=0.05mol/L;
④50mL 0.02mol/L CaCl2溶液中c(Cl-)=0.04mol/L;
则AgCl的溶解度由大到小排列顺序是:①>②>④>③,
故选B.
点评 本题考查难溶电解质的溶解平衡,题目难度不大,明确影响难溶物溶解平衡的因素为解答关键,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 【系列一】实验 | 溶液X | 实验现象 | |
| 实验Ⅰ | 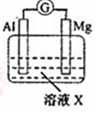 | 1mol/L稀硝酸 | 观察到电流计指针向左偏转. |
| 实验Ⅱ | 6mol/L稀硝酸 | 观察到电流计指针向左偏转,铝片表面产生无色气体,在液面上方变为红棕色 | |
| 实验Ⅲ | 6mol/LNaOH溶液 | 观察到(现象写在答题处). | |
| 实验Ⅳ | 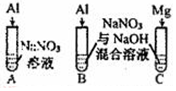 | A、C中均无明显现象,B中有无色气体生成. | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子从电极a经电解质溶液流向电极b | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 放电一段时间后,正极消耗的OH-和负极生成的OH-的量相等 | |
| D. | 电池的负极反应为BH4--8e-+8OH-=BO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 分别测定饱和NaClO溶液与饱和CH3COONa溶液的pH,pH(NaC1O)>pH(CH3COONa) | ClO-结合H+的能力比 CH3COO- 的强 |
| B | 25℃时,向pH等于2的醋酸溶液中加入少量0.0lmol•L-1的稀盐酸,溶液的pH会变小 | 醋酸的电离程度增大 |
| C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| D | 向2mL2%NaOH溶液中加入lmLl%CuSO4溶液,振荡后滴加0.5mL5%葡萄糖溶液,加热至沸腾,出现红色沉淀 | 葡萄糖中含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制水闸门常与直流电源的正极相连,可防止其腐蚀 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| D. | 一定温度下,CH3COOH稀溶液中加入少量的冰醋酸,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com