
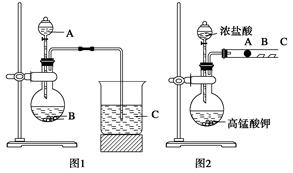
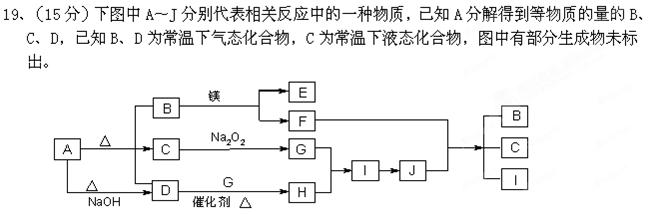
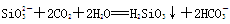 (2分)
(2分) 。
。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 B+镁 → E + F
B+镁 → E + F  。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
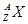 ,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的
,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X Y2 | B.XY | C.XY3 | D.X2Y3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.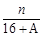 (A-N+8)mol (A-N+8)mol | B.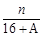 (A-N+10)mol (A-N+10)mol |
| C.(A-N+2)mol | D. (A-N+6)mol (A-N+6)mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A和C 1∶1 | B和A 1∶2 | D和E 1∶3 | B和E 1∶4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素编号 | 元素性质或结构 |
| T | M层上有2对成对电子 |
| X | 元素最高正价是+7价 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 单质是银白色固体、导电、密度比水小,与水剧烈反应、和氧气反应不同条件下产物不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
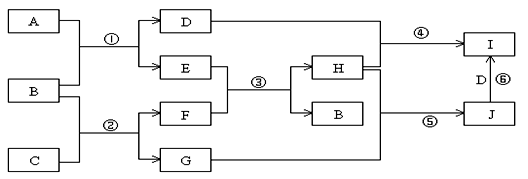
 ,并且存
,并且存 在如下转换关系:
在如下转换关系:
 原剂的质量比为 。
原剂的质量比为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com