
250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ•mol﹣1,自发进行的原因是( )
|
| A. | 是吸热反应 | B. | 是放热反应 |
|
| C. | 是熵减少的反应 | D. | 熵增大效应大于焓变效应 |
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
阅读下列实验内容,根据题目要求回答问题.
某学生为测定未知浓度的硫酸溶液,实验如下:以0.14mol•L﹣1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
(1)该学生用标准0.14mol•L﹣1NaOH溶液滴定硫酸的实验操作如下:
A、检查滴定管是否漏水
B、用蒸馏水洗干净滴定管
C、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2﹣3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
D、用待测定的溶液润洗酸式滴定管
E、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂.
F、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G、另取锥形瓶,再重复操作一次
①该滴定操作中应选用的指示剂是 ;
②在F操作中如何确定终点? .
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (选填“甲”或“乙”)中.
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) .
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
稀的醋酸溶液中存在平衡CH3COOH⇌CH3COO﹣+H+(正方向吸热),要使溶液中c(H+)减小,下列操作正确的是( )
|
| A. | 溶液中加入氢氧化钠固体 | B. | 溶液中通入HCl气体 |
|
| C. | 使醋酸溶液的温度升高 | D. | 加入纯醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2(g)⇌CO(g)+Cl2(g);△H>0.当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
|
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1mol•L﹣1醋酸溶液加水稀释,下列说法正确的是( )
|
| A. | 溶液中c(H+)和c(OH﹣)都减小 | B. | 溶液中c(H+)增大 |
|
| C. | 醋酸电离平衡向左移动 | D. | 溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
过量的铜与浓硫酸在加热条件下的反应会因硫酸浓度下降而停止。为测定反应残余清液中硫酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量BaCl2溶液反应,称量生成的BaSO4质量。
乙方案:与足量锌反应,测量生成氢气的体积。
回答下列问题:
⑴判定甲方案不可行,理由是 。
⑵甲同学用图所示装置进行乙方案的实验。
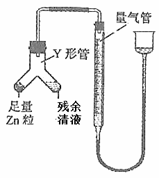
①检查此装置气密性的方法 。
②使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。残余清液与锌粒混合后的现象 。
③反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
⑶乙同学拟选用下列实验装置完成实验:

①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后残余清液就不能顺利滴入锥形瓶。其原因是 。
③乙同学滴入锥形瓶中的残余清液体积为amL,测得量筒中水的体积为bmL(假设体系中气体为标准状况),残余清液中硫酸的物质的量浓度的表达式__________(用a、b表示)
④某学生想用排水法收集氢气,并检验其纯度,应选择集气装置__________(填A或B)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com