
【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.
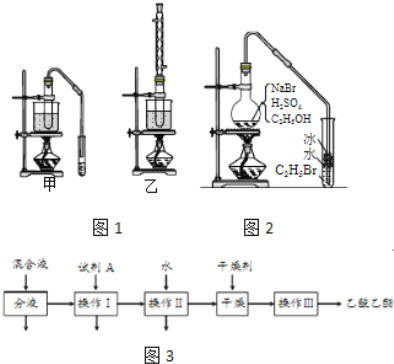
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______.
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是______(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______.(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是______.(选填编号)
物质 | 沸点(℃) |
乙醇 | 78.5 |
乙酸 | 117.9 |
乙酸乙酯 | 77 |
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3,以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物.
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色.与方案①相比较,方案②的明显缺点是______.
【答案】利用浓硫酸的吸水性,使反应向有利于生成乙烯的方向进行 NaOH d b、d Na2CO3 分液 相互溶解但沸点差别较大的液体混合物 Na2SO3 先加浓硫酸会有较多HBr气体生成,HBr挥发会造成HBr的损耗.
【解析】
(1)乙醇制取乙烯,生成物中含有水,浓硫酸具有吸水性,据此解答即可;
(2)乙醇在浓硫酸作用下生成乙烯,产物中可能含有二氧化硫,二氧化硫存在会对乙烯的验证造成干扰,由于二氧化硫与氢氧化钠反应生成亚硫酸钠,故可以利用氢氧化钠将二氧化硫除去;乙烯与溴水发生加成反应生成而溴乙烷,是油状液体,据此解答即可;
(3)甲装置采取边反应边蒸馏的方法,乙装置则采取直接回流的方法,待反应后再提取产物,所以乙装置更充分反应;
(4)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,干燥后的乙酸乙酯需要精馏;
(5)按方案①和②实验时,产物都有明显颜色,即会有溴单质生成,溶于水形成橙红色;溴化氢具有挥发性,把浓硫酸加入到溴化钠中会有HBr生成,导致HBr损失,据此解答即可。
(1)乙醇制取乙烯,生成物中含有水,浓硫酸具有吸水性,故利用浓硫酸的吸水性,使反应可以向有利于生成乙烯的方向进行;
(2)乙醇在浓硫酸作用下生成乙烯,产物中可能含有二氧化硫,二氧化硫存在会对乙烯的验证造成干扰,由于二氧化硫与氢氧化钠反应生成亚硫酸钠,故可以利用氢氧化钠将二氧化硫除去;乙烯与溴水发生加成反应生成而溴乙烷,是油状液体,故答案为d;
(3)甲装置采取边反应边蒸馏的方法,乙装置则采取直接回流的方法,待反应后再提取产物,所以乙装置更充分反应,乙酸转化率高,故选b、d;
(4)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可,干燥后的乙酸乙酯中仍混有少许有机物杂质,需要精馏,精馏一般适用于相互溶解但沸点差别较大的液体混合物;
(5)按方案①和②实验时,产物都有明显颜色,即会有溴单质生成,溶于水形成橙红色,溴单质具有氧化性,能与亚硫酸钠反应生成硫酸钠和溴化钠;溴化氢具有挥发性,把浓硫酸加入到溴化钠中会有HBr生成,导致HBr损失。


科目:高中化学 来源: 题型:
【题目】燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g)![]()
![]() CaS(s)+CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
CaS(s)+CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
(1)计算反应CaO(s)+3CO(g )+SO2(g) ![]() CaS(s)+3CO2(g) ΔH=____________。
CaS(s)+3CO2(g) ΔH=____________。
(2)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应I,下列能说明该反应已达到平衡状态的是_____________(填序号)
a.容器内的压强不发生变化 b.υ正(CO)=υ正(CO2)
c.容器内气体的密度不发生变化 d.n(CO)+n(CO2)=1mol
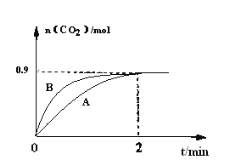
(3)一定温度下,体积为1L容器中加入CaSO4(s)和1molCO,若只发生反应II,测得CO2的物质的量随时间变化如下图中曲线A所示。
①在0~2min内的平均反应速率v(CO)=____________。
②曲线B表示过程与曲线A相比改变的反应条件可能为____________(答出一条即可)。
(4)烟道气中的SO2和CO2均是酸性氧化物,也可用氢氧化钠溶液吸收。
已知:25℃时,碳酸和亚硫酸的电离平衡常数分别为:
碳酸 K1=4.3×10-7 K2=5.6×10-11
亚硫酸K1=1.5×10-2 K2=1.0×10-7
①下列事实中,不能比较碳酸与亚硫酸的酸性强弱的是________(填标号)。
a.25℃下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
b.25℃下,等浓度的NaHCO3溶液pH大于NaHSO3溶液
c.将SO2气体通入NaHCO3溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
d.将CO2气体通入NaHSO3溶液,逸出气体通入品红溶液,品红溶液不褪色
②25℃时,氢氧化钠溶液吸收烟道气,得到pH=6的吸收液,该溶液中c(SO32-):c(HSO3-)=___________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳环保,减轻大气污染,必须从源头上对尾气进行净化处理。回答下列问题
(1)汽车尾气催化转换器中的反应为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。若在密闭容器中发生该反应时,c(N2)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。若在密闭容器中发生该反应时,c(N2)随温度(T)和时间(t)的变化曲线如图所示。
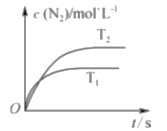
①由图甲可知,温度T1_____T2(填“>”或“<”,下同);该反应的△H_____0。
②能提高尾气转化率的措施有_____(填字母)。
a.升高温度 b.降低温度 c.增大压强 d.增大催化剂的比表面积
(2)煤燃烧产生的烟气中含有氮氧化物,可用CH4催化还原NOx,消除氮氧化物的污染。已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJmol﹣1,②N2O4(g)2NO2(g)△H=+56.9kmol﹣1,③CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣810.1kJmol﹣1,从原电池的工作原理分析,可设计为原电池的反应为_____(填序号)。
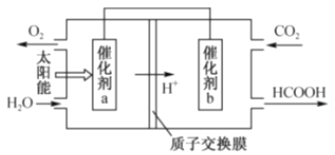
(3)下图是通过光电转化原理,以燃煤产生的二氧化碳为原料,制备新产品的示意图。试写出光电转化过程中总反应的化学方程式:_____;催化剂a、b之间连接导线上的电流方向是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置进行实验,下列有关说法正确的是( )
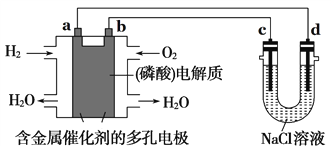
A. 电子流向为:电极a → 电极d →电极c →电极b
B. 电极b发生的电极反应为O2 + 2H2O + 4e- = 4OH-
C. 在电极a参与反应的气体体积在相同状况下与在电极c产生的气体体积为1:1
D. 为了防止大气污染,应在d端的U形管出口连接导管通入到NaOH溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是生产和生活中用量较多的金属。
(1)下列有关铜元素的说法中,不正确的是__________(填字母)
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应生成黑色的CuO
D.CuSO4·5H2O是一种混合物,加热后变为白色固体
(2)某化学小组为测定某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
①请写出方案Ⅰ中铜与稀硝酸反应的离子方程式:___________,该方案中稀硝酸表现出来的性质是___________(填字母)。
A.挥发性 B.酸性 C.氧化性 D.还原性
②方案Ⅱ比方案Ⅰ更易于实施,理由是________________。请写出方案Ⅱ中发生反应的化学方程式:____________,该反应产生气体在标准状况下的体积为________(铜铝混合物质量是m1g,反应后剩余固体的质量m2g,用含m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
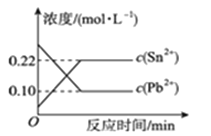
A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D. 25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
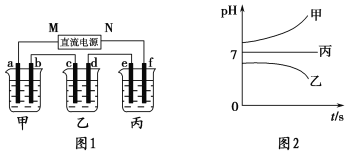
(1)M为直流电源的________极,b电极上发生的电极反应为______________________。
(2)计算e电极上生成的气体在标准状况下的体积为________________。
(3)写出乙烧杯中的总反应方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3),过程如下:

(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是____。
(2)还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:_____。
(3)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是__。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(二)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
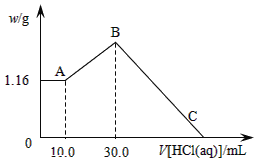
(1)原混合物中NaOH的质量是____g。
(2)C点(此时沉淀恰好完全溶解)HCl溶液的体积为___mL。
(三)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过如图1过程制备ClO2:
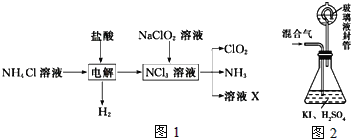
用如图2装置可以测定混合气中ClO2的含量:
Ⅰ、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ、将一定量的混合气体通入锥形瓶中吸收;
Ⅳ、将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ、用0.1000molL1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①测得混合气中ClO2的质量为___g。
②用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___(填标号).
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
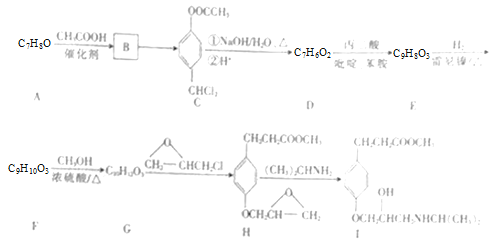
【题目】有机物Ⅰ(英文名为Esmolol)是治疗快速室上性心律失常、急性心肌缺血、术后高血压等的理想药物,Esmolol的合成路线如图:
已知: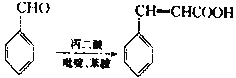
回答下列问题:
(1)C中官能团的名称有____。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。则有机物Ⅰ中的手性碳数目有____个。
(3)G→H的反应类型为____;B→C反应需要的试剂和条件为____。
(4)C→D中步骤①反应的化学方程式为_____。
(5)E的结构简式为____。
(6)X是F的同分异构体,则满足下列条件的X的结构有___种。
①能发生水解反应和银镜反应;
②能与FeCl3溶液发生显色反应,且苯环上有三个取代基。
(7)参照上述合成路线,设计以 、CH3OH和
、CH3OH和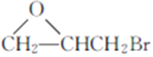 为主要原料制备
为主要原料制备 的合成路线。______
的合成路线。______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com